что делать в этой ситуации (срочно)?
Краткое содержание статьи:
- Чем отличается кислота от щелочи?
- Что будет, если выпить щелочь?
- Особенности химического ожога
- Чем смыть щелочь?
- Элементарные правила безопасности
- Чем нейтрализовать щелочь на коже?
- Видео: срочная помощь при химическом ожоге
Щелочь в различных видах используют не только в химической промышленности. Она применяется при очистке различных поверхностей, дезинфекции и т. д. Но при обращении с ней надо соблюдать осторожность, чтобы не получить ожог.
Чем отличается кислота от щелочи?
Эти два вещества являются антиподами. Взаимодействие щелочи и кислоты приводит к образованию воды и взаимному уничтожению друг друга. При этом реакция проходит достаточно бурно, с шипением и повышением температуры среды взаимодействия.
Щелочь, в отличие от кислоты, опаснее для кожи человека.
Хотя многие полагают, что все наоборот. Щелочь быстрее образует сильный ожог за счет глубокого проникания в кожу, к тому же смыть ее непросто.
Определить, какое вещество находится в емкости, можно даже без специального оборудования. Достаточно приобрести лакмусовую полоску. Она обладает особым составом, который реагирует на кислотные и щелочные среды. Опущенный в кислоту лакмус станет красным, а в щелочной среде обретет синий оттенок.
Что будет, если выпить щелочь?
У выпившего щелочь человека наблюдается следующая симптоматика:
- Ожог рта. Мягкие ткани отекают и приобретают красный цвет. Человек страдает от сильной боли. Постепенно отеки преобразуются в язвы;
- Появляется жажда. Во рту долго стоит металлический привкус;
- Боль в области груди. Ее интенсивность зависит от концентрации выпитой щелочи;
- Сильная рвота с вкраплениями крови. Связано это с тем, что щелочь повреждает внутренние сосуды;
- Риск асфиксии из-за интенсивной рвоты или деформированных пищеводных тканей;
- Состояние шока.
 Если концентрация щелочи высока, то болевой симптом приводит к исступлению человека, он перестает разумно мыслить и порой даже не в состоянии вызвать медиков;
Если концентрация щелочи высока, то болевой симптом приводит к исступлению человека, он перестает разумно мыслить и порой даже не в состоянии вызвать медиков; - Спустя какое-то время после первичных симптомов наступает кровавый понос.
Анализируя случаи отравления щелочью, врачи пришли к выводу, что желудок может вовсе не пострадать. Ведь при взаимодействии выпитой щелочи с кислотной средой желудка происходит нейтрализация первой.
Но если концентрация вещества достаточно высока, то есть вероятность перфорации пищевода, то есть образования в нем отверстия.
Даже употребление небольших доз щелочных растворов чревато осложнениями, хотя поначалу человек может отделаться слабовыраженными симптомами. Поэтому никакого самолечения, только оперативное обращение к врачу.
Также специалисту нужно сообщить название вещества, ставшее причиной отправления. Это поможет сразу подобрать курс лечения и не тратить время на дополнительные обследования.
Часто впавшие в шоковое состояние пострадавшие совершают ряд опасных ошибок:
- Вызывают рвоту. Она в несколько раз повышает риск повреждения пищевода. Ведь щелочная жидкость из желудка вновь пойдет назад по тому же пути, что попала внутрь;
- Употребляют слабительные. Только врач может решить, насколько целесообразен тот или иной метод детоксикации;
- Пьют раствор лимонной кислоты. Эта ошибка связана с тем, что люди имеют общие представления о нейтрализации щелочи кислотой. Но то, что актуально для бытового применения, никак не поможет при отравлениях. Кислотный раствор может дать лишь дополнительную нагрузку на отравленный организм.
Особенности химического ожога
Ожог щелочью чаще всего приводит к опасным осложнениям. К примеру, некоторые другие агрессивные вещества сразу вступают в реакцию с кожным покровом. Он разъедается, но зато основная часть химического средства не попадает глубже.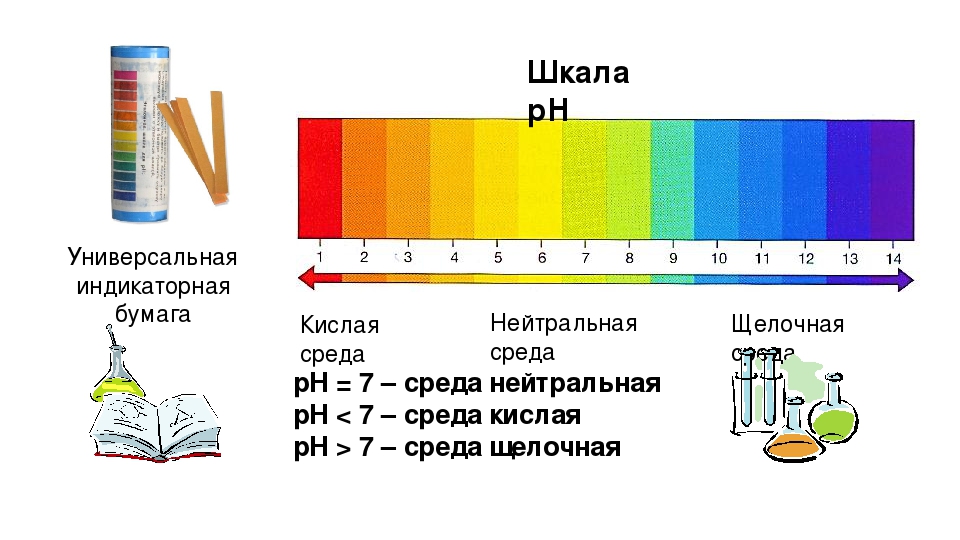
С щелочью все иначе. Она может не образовать ожоговой корки и быстро проникает в глубокие слои кожи. На месте взаимодействия щелочи и кожи появляется рыхлый струп светлого оттенка. Поврежденные ткани отделяются медленно, что осложняет заживление. Это также повышает риск появления на месте щелочных ожогов рубцов.
Когда химическое средство попадает на кожу, то появляется:
- Раздражение;
- Отек;
- Покраснение;
- Нарастающая боль, становящаяся невыносимой в случае ожога щелочью высокой концентрации;
- Онемение.
В некоторых случаях пострадавшие говорят о том, что появлялось ощущение, будто их кожа «мыльная».
Если концентрация щелочи была слабой и она воздействовала на кожу недолго, то человек отделается поверхностным ожогом. Кожа станет слегка бордовой, появится тупая боль и жжение.
В тяжелых случаях при повреждениях глубоких слоев кожи под ней может образоваться гной. Это создает дополнительный риск воспалительного процесса.
Чем смыть щелочь?
В быту люди часто получают ожоги негашеной известью. Она как раз и представляет собой щелочь. Многие пострадавшие в этом случае инстинктивно пытаются смыть реагент обычной водой. Это не только не поможет, но еще больше усилит действие щелочи.
Если на кожу попала негашеная известь, то ее удаляют сухой салфеткой. Затем поврежденную кожу смазывают растительным маслом. Если воспаление сильное и вызывает острую боль, то надо обратиться к медикам.
Другие виды щелочей надо смывать прохладной водой. Чтобы эффективно избавиться от реагента, надо держать поврежденную кожу под струей около 15 минут.
Нельзя вытирать кожу полотенцем. На коже могут успеть образоваться рыхлые струпья, поэтому при трении кожа еще больше травмируется.
Элементарные правила безопасности
Все щелочные растворы должны находиться там, где до них не сможет добраться ребенок. Достаточно часто опасными реагентами случайно обливаются дети, которые пытались открыть интересные для них бутылочки с жидкостью. При этом недостаточно того, чтобы емкости были закрытыми, так как ребенок вполне может их разбить.
При этом недостаточно того, чтобы емкости были закрытыми, так как ребенок вполне может их разбить.
При работе с щелочными средствами следует надевать резиновые перчатки. Если вещество имеет резкий запах, то нужна защитная маска. Ведь даже вдыхание паров некоторых реагентов может вызвать отравление.
Чем нейтрализовать щелочь на коже?
Особенность щелочи заключается в том, что щелочь еще некоторое время может воздействовать на кожу, даже если следов самого вещества уже нет. Поэтому, когда пораженный участок кожи промыт водой, его следует обработать раствором уксуса. Данная кислота прекрасно нейтрализует остатки щелочи.
Если ожог небольшой, то после промывания водой и уксусом можно самостоятельно использовать различные лекарства, ускоряющие заживление. Подойдет недорогая мазь Левомеколь, которая оказывает противомикробное действие и устраняет воспаление.
Если появилась гноящаяся рана, то поможет Левосин. Мазь также усиливает регенерационные процессы кожи.
Важно отметить, что использование препаратов актуально лишь в случае отсутствия осложнений. Кожа, которая долго не заживает после щелочного ожога или приобрела неестественный цвет, является сигналом для настороженности и квалифицированного лечения.
Выходит, что попадание щелочи на кожу может вызвать долго заживаемый ожог с осложнениями. Просто промыть рану и обработать ее бывает недостаточно. Особенно если концентрация вещества была высокой или повреждена значительная площадь кожи. В этом случае не обойтись без помощи врача.
Видео: срочная помощь при химическом ожоге
В этом ролике врач Ирина Васильченко расскажет, что нужно сделать в первую очередь при попадании на кожу щелочи, чем нейтрализовать ее:
Чем нейтрализовать щелочь в домашних условиях medistok.
 ru — жизнь без болезней и лекарств medistok.ru
ru — жизнь без болезней и лекарств medistok.ruСодержание
- 0.1 Чем опасны кислоты и щелочи
- 0.2 Приготовление нейтрализующего раствора
- 0.3 Что делать при химических ожогах
- 0.4 Что делать при разливах
- 0.5 Что делать при пожарах
- 1 Химические и физические свойства щелочей и их растворов
- 1.1 Щелочные сливы предприятий
В связи с тем, что по роду своей профессии мне приходилось много раз сталкиваться и со щелочами, и с кислотами, то могу рассказать, чем чревато незнание того, как оказывать первую помощь при ожоге тем или другим.
Одна из историй: шло занятие в институте, девушка пролила кислоту (сейчас не подскажу какую, но толи соляная, толи серая…) на рабочий стол и начала вытирать тряпкой, которой мы вытирали столы от мусора, но ни как не от химикатов.
Естественно тряпка быстро пропиталась кислотой и соответственно…попала на руки девушке, которая в порыве быстрой уборки даже и не заметила этого. И тут она берет и чешет щеку и глаз одной из рук….и продолжает убирать.
И тут она берет и чешет щеку и глаз одной из рук….и продолжает убирать.
Через какое-то время мы видим, как она стоит, наклонясь над раковиной и усердно промывает водой лицо, при этом подвывая…конечно же становится ясно, что не просто так она решила поумываться на работе. В итоге её преподаватель пожурил, заставил хорошо вымыть руки и только потом осторожно промыть лицо. Ожог был небольшой, в виде покраснения легкого. Но уроком послужило всем.
Хотя, скажу, что я не раз тоже обжигалась, но все заканчивалось хорошо. ) Да и какой химик не попробовал себе парочку0троечку химикатов )))
Итак, давайте рассмотрим, что надо делать при ожогах кислотами или щелочами.
В настоящее время мы часто используем различные моющие, чистящие средства, содержащие химические вещества. Химические вещества используют в школе на уроках химии, в промышленности, в сельском хозяйстве и т.д. Вот, например, вы купили новое средство для «своих любимых» колорадских жуков, переборщили с дозировкой, начали опрыскивать картошку, ветер был в вашу сторону, и, струя с раствором попала вам на рубашку, пропиталась и попала на кожу. Вот вы и заработали химический ожог. А вы, женщины, решили сэкономить, купили на рынке или в супермаркете недорогое средство для чистки ванны, а оно сделано без соблюдения норм содержания химических веществ, и, конечно же, вы начали чистить ванну без перчаток, средство попало на кожу, кожа покраснела и стала болеть. Налицо химический ожог. Также химические ожоги возникают при попадании на кожу концентрированных кислот, щелочи, это случается и в промышленности, и в быту. Перечислим основные правила оказания первой помощи при химических ожогах.
Вот вы и заработали химический ожог. А вы, женщины, решили сэкономить, купили на рынке или в супермаркете недорогое средство для чистки ванны, а оно сделано без соблюдения норм содержания химических веществ, и, конечно же, вы начали чистить ванну без перчаток, средство попало на кожу, кожа покраснела и стала болеть. Налицо химический ожог. Также химические ожоги возникают при попадании на кожу концентрированных кислот, щелочи, это случается и в промышленности, и в быту. Перечислим основные правила оказания первой помощи при химических ожогах.
Внимание! Необходимо немедленно удалить одежду, пропитанную кислотой или щелочью, и обильно промыть пораженный участок проточной водой (не менее 10—15 мин.), но не под напором! Если помощь оказывается с некоторым опозданием, продолжительность обмывания увеличивают до 30—40 мин. Эффективность первой помощи оценивают по исчезновению характерного запаха химического вещества или по изменению цвета лакмусовой бумаги. Необходимо именно смывать под струей воды, а не пытаться вытереть химические вещества салфетками, тампонами, смоченными водой, с пораженного участка кожи – так вы еще больше втираете химическое вещество в кожу.
В-третьих, необходимо знать, что в оказание первой помощи при химических ожогах входит нейтрализация действия химвеществ. Если вы обожглись кислотой – обмойте поврежденный участок кожи мыльной водой или 2-х процентным раствором питьевой соды (это 1 чайная ложка питьевой соды на 2,5 стакана воды), чтобы нейтрализовать кислоту. Если вы обожглись щелочью, то обмойте поврежденный участок кожи раствором лимонной кислоты или уксуса.
В-четвертых, наложить сухую марлевую повязку и обратиться к врачу.
Уважаемые хочульки и мамочки, все ожоги происходят из-за нашей невнимательности к себе и своим близким, а тяжелые последствия в виде шрамов и т.д. происходят из-за растерянности в трудную минуту и иногда незнания элементарных правил оказания первой помощи. Сегодня мы ознакомиись с тем, как оказывать первую помощь пострадавшим от ожогов. Теперь вы, запомнив все эти минимально необходимые правила, вполне сможете самостоятельно оказать помощь в подобных ситуациях.
И будьте внимательны к себе и своим близким! Не теряйтесь! Будьте уверены в своих силах!
При строгом соблюдении техники безопасности при хранении и транспортировке кислот и щелочей, а также при работе с ними, вероятность аварийной ситуации крайне мала. Тем не менее, знать, как действовать в случае ее возникновения, надо обязательно. Это может спасти чье-то здоровье или даже жизнь!
Тем не менее, знать, как действовать в случае ее возникновения, надо обязательно. Это может спасти чье-то здоровье или даже жизнь!
Чем опасны кислоты и щелочи
Контакт с кислотами и щелочами может вызвать химические ожоги; особенно опасны щелочные ожоги. Пары негативно влияют на дыхательную систему, вызывая раздражение дыхательных путей и даже отек легких. Кроме этого, во многих реакциях с этими соединениями образуется водород — горючий и взрывоопасный газ. Именно поэтому большинство опытов с ними следует проводить в вытяжном шкафу. Очень опасны концентрированные кислоты: азотная и серная. Их контакт с органическими материалами может привести к самовозгоранию последних.
Все сотрудники лабораторий, имеющих дело с едкими реактивами, обязаны уметь оказывать первую помощь при химических ожогах; знать, где расположены аптечка, нейтрализующие растворы, песок и опилки. По технике безопасности в аптечке должны находиться по 1 л раствора борной или лимонной кислоты и раствора соды, или комплект PLUM с нейтрализующими растворами.
Приготовление нейтрализующего раствора
Для приготовления нейтрализующего раствора берут 1 литр воды и 10 г реактива (лимонной кислоты, борной кислоты, соды). Размешивают до полного растворения всех твердых частиц и переливают в пластиковые сосуды подходящего размера. Потом на них наклеивается этикетка с хорошо читаемым указанием названия, концентрации и назначения («нейтрализующий раствор для кислоты», «нейтрализующий раствор для щелочи»).
Приготовленные растворы должны храниться в аптечке или рядом с ней.
Что делать при химических ожогах
• Место ожога кислотой заливают 1%-ным раствором питьевой соды.
Место поражения щелочью обильно поливают 1%-ным раствором лимонной или борной кислоты.
Для химических ожогов специально предназначена нейтрализующая жидкость из комплекта PLUM (выливается весь флакон).
• Если кислота или щелочь попали в глаза, то они промываются нейтрализующим раствором, разведенным вдвое.
• После этого место ожога промывают водой, мылом и снова водой. Промывание водой должно длиться не менее 15 минут.
Промывание водой должно длиться не менее 15 минут.
• Пострадавшего должен осмотреть врач для определения дальнейшего лечения. При необходимости вызывают «Скорую помощь».
Что делать при разливах
При разливе едкого хим. реактива крайне важно знать характер вещества. Кислоты засыпаются только песком — ни в коем случае не опилками! Щелочи засыпают опилками или песком.
После того, как вся жидкость впиталась, песок или опилки сметают и утилизируют (захоранивают или передают на утилизацию сертифицированным организациям). Место пролива заливают нейтрализующим раствором (раствором соды или лимонной, борной кислоты), промывают водой и вытирают насухо.
Что делать при пожарах
Сами кислоты и щелочи, как правило, относятся к негорючим веществам, но они могут разлагаться при нагревании или вступать в реакции с металлами или органическими материалами, выделяя токсичные и горючие газы и вещества.
Если в зоне пожара оказались кислоты или щелочи, то все участвующие в тушении должны быть об этом проинформированы.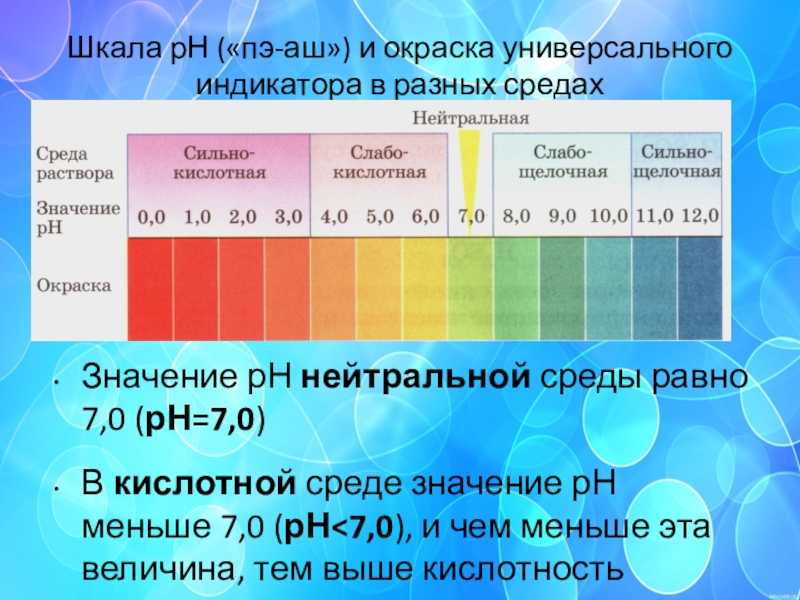
Пожар, в зоне которого оказались кислоты или щелочи, тушат песком, химической пеной, углекислым газом, мелкораспыленной водой.
Завод водоочистного оборудования ООО «ПЗГО» приветствует всех на странице своего официального сайта, посвященной такой теме как нейтрализация щелочи, щелочных стоков и вод в промышленном масштабе.
Прежде чем перейти к теоретической части вопроса, хотелось бы обратить Ваше внимание на наши собственные недорогие, компактные и высокоэффективные очистные станции модельного ряда «ШВ», изготавливаемые по уникальным патентам и собственным многолетним наработкам.
Строго учитываем все аспекты Заказа: объем, агрессивность и концентрацию очищаемой среды, пространственное размещение станций, а также экономическую подоплеку Вашего производственного предприятия.
Для запроса цены или обсуждения тонкостей Вашего Заказа на систему очистки щелочных или кислых стоков, пожалуйста, контактируйте с Клиентским отделом ООО «ПЗГО» любым удобным способом или воспользуйтесь кнопкой ниже, и мы свяжемся с Вами в течение 1 часа рабочего дня.
Щелочи, с химической точки зрения, представляют собой гидроксиды щелочных и щелочноземельных металлов (группы в периодической таблице – Ia и IIa). К таким металлам относятся натрий (образует каустическую соду), калий (едкое кали), барий (едкий барий), бериллий, стронций, унбинилий, литий, цезий, франций. Все щелочные растворы проявляют основные свойства, но не наоборот.
Одним из самых важных химических свойств оснований является активное вступление в реакцию с кислотами – реакция нейтрализации, ведущая к ассоциативному образованию солей и воды. Эта особенность широко используется при проектировании оборудования для нейтрализации промышленных выбросов.
Последствия, вызванные индустриальными стоками
Физически, эти соединения – твёрдые белые порошки (кристаллы), имеющие предельный коэффициент гигроскопичности, интенсивно поглощающие из воздуха воду, углекислый газ, а также другие газы и жидкости. Имеют высокий показатель растворимости в воде, что также берется в расчет при проектировании станций очистки стоков.
Кристалы едкого натра
Гигроскопичностью и экстремальной биологической опасностью алкалинов продиктованы крайне осторожные меры обращения с этими соединениями: щелочные ожоги кожи и дыхательных путей в значительной мере превосходят повреждения, полученные при равных обстоятельствах от кислоты.
Щелочные сливы предприятий
В очистке или нейтрализации стоков основного свойства нуждаются множественные производственные и обрабатывающие предприятия, а также лаборатории – независимые или прикрепленные к тому или иному предприятию. Рассмотрим основные направления.
Стоит заметить, что проблемой утилизации сточных сливов обеспокоены не только те компании, которые используют сами щелочи, но, как правило, и те, в чьих технологических циклах участвуют калий, натрий, магний, кальций, стронций, барий, бериллий, литий, цезий.
Методы и способы нейтрализации щелочи
Основным водоочистным методом в промышленности является нейтрализация щелочи кислотой. Наш завод предлагает к расчету, изготовлению и продаже установки, реализующие нижеследующий метод очистки.
Наш завод предлагает к расчету, изготовлению и продаже установки, реализующие нижеследующий метод очистки.
Реакция с кислотой
В основной бак установки заливается щелочной раствор. Система автоматически детектирует его концентрацию и через насос-дозатор подает в реактор необходимое количество кислого раствора, (состав которого зависит от очищаемой среды: азотная, серная, соляная и другие кислоты).
Принципиальная схема станции нейтрализации стоков. 1, 2 – резервуары для реагентов, 3 – главный бак-реактор, 4 – усреднитель (отстойник)
После это включается механическая мешалка, работа которой способствует более продолжительному контакту реагентов и более полному протеканию реакции. Параллельно с этим, в режиме онлайн, pH-датчиками идет сверка текущих показаний с заданными параметрами.
По достижении требуемого уровня pH мешалка выключается и включается центробежный насос, который сливает прореагировавший раствор в канализационную магистраль. Объем бака и реагента прямо зависит от потребностей Заказчика. Помимо прочего, установка может быть оснащена дополнительными емкостями для буферного хранения агентов, очищаемых или очищенных жидкостных масс.
Помимо прочего, установка может быть оснащена дополнительными емкостями для буферного хранения агентов, очищаемых или очищенных жидкостных масс.
Комплекс водоподготовки для промышленных сливов предприятий
Очистка щелочи углекислым газом
Второй по распространенности метод алкалиновой нейтрализации – насыщение раствора углекислотой – в жидком или газообразном состоянии.
Углекислотная установка водоочистки: основными элементами здесь являются бак-нейтрализатор и баллоны с CO2
В принципе, если взглянуть на этот подход более детально, то можно увидеть, что он также задействует технологию кислотного очищения: подающийся в сток углекислый газ, взаимодействуя с водой, «на лету» образует слабую угольную кислоту – именно она и нейтрализует щелочь.
Озонирование
В дополнение к двум вышеперечисленным методам стоит добавить озонирование – самый сложный и трудозатратный вариант нейтрализации щелочи. Чаще всего озонирование применяется для биологической ректификации воды и только там, где это действительно оправдано: уничтожение опасных микробов, бактерий, плесени, грибков, очищение стоков от нефтепродуктов, цианидов, ароматических углеводородов.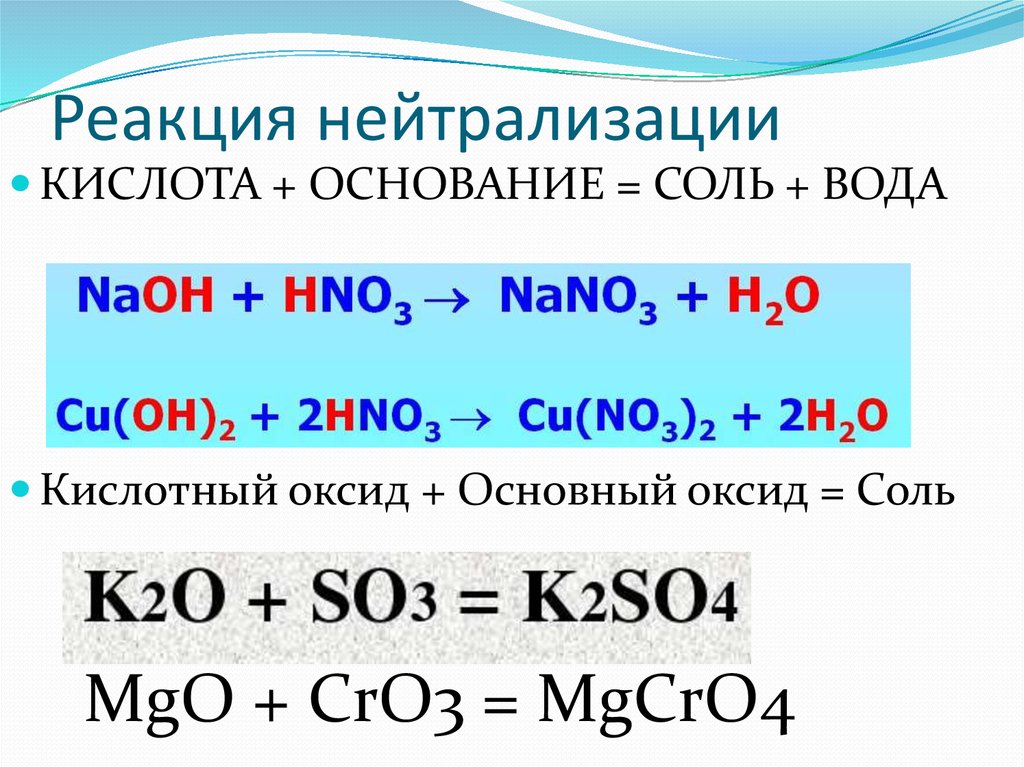
Ограниченно озонирование воды для достижения требуемого уровня pH применяется в рыбных хозяйствах (фермах), а также в больших аквариумах, океанариумах.
Кстати, трехатомный кислород (озон) в естественной среде существует всего от нескольких до нескольких десятков минут, после чего распадается на O2 с отрицательным изменением энтальпии ΔH (экзотермическая реакция).
Сводная таблица эффективности методов нейтрализации щелочи
| Способ | Плюсы | Особенности |
| Кислотный |
 Низкие эксплуатационные траты.
Низкие эксплуатационные траты.Заказ, покупка, доставка и монтаж установок щелочной нейтрализации
По любым вопросам, касающимся индивидуального проектирования, изготовления и недорогого приобретения современных и эффективных промышленных систем очистки стоков, пожалуйста, контактируйте с нашим заводом удобным Вам способом.
Осуществим быструю и аккуратную доставку оборудования по России, СНГ или странам Зарубежья. При необходимости проведем профессиональный монтаж или шефмонтаж «под ключ».
Полный комплект документации: схемы, чертежи, паспорта, сертификаты. Гарантия на станции и выполненные работы.
Как нейтрализовать кислоты и основания
Разливы опасных веществ должны быть абсорбированы, нейтрализованы или контролироваться во время происшествия, чтобы обеспечить безопасность на рабочем месте. Кислотная и щелочная нейтрализация помогает сделать разлитые материалы более безопасными при обращении и снизить стоимость утилизации.
Как узнать, является раствор кислотным или щелочным?
Лучший способ определить, является ли материал кислотным или щелочным, — это измерить его рН. Это можно сделать с помощью рН-бумаги, химических индикаторов или рН-метров. Шкала pH измеряется от 0 до 14. Химические вещества с pH от 0 до 3 считаются сильными кислотами. Химические вещества с рН от 12 до 14 считаются сильными основаниями. Чтобы считаться нейтральным, химическое вещество должно иметь pH 7,9.0004
Чтобы считаться нейтральным, химическое вещество должно иметь pH 7,9.0004
Кислоты обычно имеют кислый вкус и рН менее 7. Существует два типа кислот: минеральные (неорганические) кислоты, такие как серная, соляная или азотная, и карбоновые (органические) кислоты, такие как муравьиная или уксусная. Для нейтрализации кислот используют слабое основание.
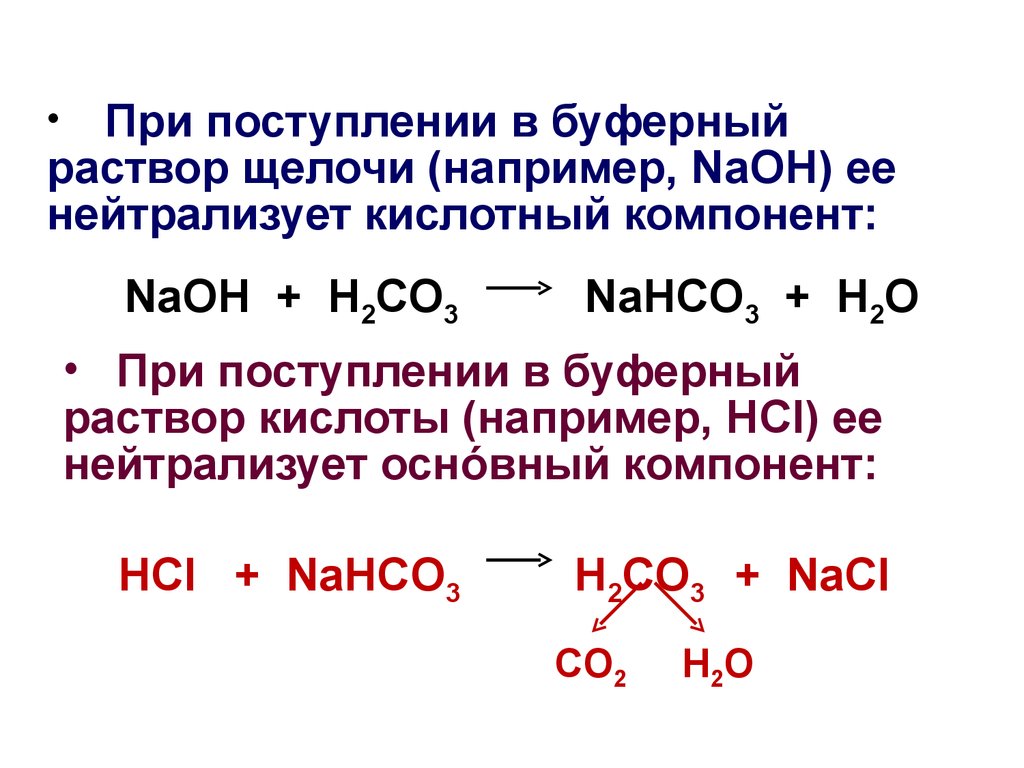
Основания имеют горький или вяжущий вкус и рН выше 7. Обычными основаниями являются гидроксид натрия, гидроксид калия и гидроксид аммония. Основания нейтрализуют слабой кислотой.
Продукты для нейтрализации кислот и оснований
Существует множество различных продуктов, помогающих нейтрализовать кислоты и щелочи. Они могут быть такими же простыми, как пакет с лимонной кислотой или бикарбонатом натрия (пищевая сода), или сложными, как отвердитель и нейтрализатор вместе взятые. Одними из основных соображений при выборе наилучшего метода нейтрализации являются безопасность (смешивание химикатов всегда является потенциально опасным процессом), стоимость и удобство.
При нейтрализации кислота и основание реагируют с образованием воды, соли и тепла. Если и кислота, и основание очень сильные (например, концентрированная соляная кислота и концентрированный гидроксид натрия), произойдет бурная реакция. Вот почему большинство нейтрализаторов очень слабые — они помогают поддерживать медленный темп реакции и уменьшают выделение тепла и газа.
Большинство производителей нейтрализаторов указывают приблизительный объем кислоты/щелочи, который их продукт нейтрализует. Для нейтрализации кислоты или основания может потребоваться большое количество продукта, особенно если он концентрированный. Некоторые нейтрализаторы кислот и оснований имеют встроенный цветовой индикатор, который сообщает вам, когда разлив нейтрализован. Другие нейтрализаторы требуют, чтобы вы проверяли pH с помощью pH-бумаги или pH-метра, чтобы контролировать процесс нейтрализации. Некоторые нейтрализаторы также затвердевают при нейтрализации разлива, что облегчает его очистку. См. сравнительные таблицы ниже для примеров соотношения обработки для некоторых распространенных нейтрализаторов кислот и щелочей.
См. сравнительные таблицы ниже для примеров соотношения обработки для некоторых распространенных нейтрализаторов кислот и щелочей.
Галлоны нейтрализованной кислоты | |||
Кислота | Spill-X-A ® | Spilfyter ® Сухая кислота | |
Уксусная кислота 99% | .30 | .25 | |
Соляная 37% | .27 | .31 | |
Гидрофтористый 49% | .25 | * | |
Азотная 70% | .55 | * | |
Перхлорная 70% | .29 | * | |
Фосфор 85% | . | .10 | |
Серный 93% | .30 | .27 | |
*Не применимо
Таблица B
Галлоны нейтрализованного основания | |||
Основание | Spill-X-C ® | Spilfyter ® Сухая основа | |
Гидроксид аммония | .41 | .25 | |
Гидроксид калия | .27 | .27 | |
Гидроксид натрия | .17 | .18 | |
Источники
Разлив ANSUL X
Корпорация NPS
Информация, содержащаяся в этой статье, предназначена только для общих информационных целей и основана на информации, доступной на дату первоначальной публикации. Не делается никаких заявлений о том, что информация или ссылки являются полными или актуальными. Эта статья не является заменой обзора действующих государственных постановлений, отраслевых стандартов или других стандартов, характерных для вашего бизнеса и/или деятельности, и не должна рассматриваться как юридическая консультация или мнение. Читатели, у которых есть конкретные вопросы, должны обратиться к применимым стандартам или проконсультироваться с юристом.
Не делается никаких заявлений о том, что информация или ссылки являются полными или актуальными. Эта статья не является заменой обзора действующих государственных постановлений, отраслевых стандартов или других стандартов, характерных для вашего бизнеса и/или деятельности, и не должна рассматриваться как юридическая консультация или мнение. Читатели, у которых есть конкретные вопросы, должны обратиться к применимым стандартам или проконсультироваться с юристом.
Нейтрализация — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1285
Реакция нейтрализации – это когда кислота и основание реагируют с образованием воды и соли и включают комбинацию H + ионов и ОН — ионов для получения воды. Нейтрализация сильной кислоты и сильного основания имеет рН, равный 7. Нейтрализация сильной кислоты и слабого основания будет иметь рН менее 7, и, наоборот, результирующий рН, когда сильное основание нейтрализует слабую кислоту, будет больше 7,
Нейтрализация сильной кислоты и сильного основания имеет рН, равный 7. Нейтрализация сильной кислоты и слабого основания будет иметь рН менее 7, и, наоборот, результирующий рН, когда сильное основание нейтрализует слабую кислоту, будет больше 7,
Когда раствор нейтрализуют, это означает, что соли образуются из равных по весу кислоты и основания. Необходимое количество кислоты равно количеству, которое дает один моль протонов (H + ), а необходимое количество основания равно количеству, которое дает один моль (ОН — ). Поскольку соли образуются в результате реакций нейтрализации с эквивалентными весовыми концентрациями кислот и оснований: N частей кислоты всегда нейтрализуют N частей основания.
| Сильные кислоты | Прочные основания |
|---|---|
| HCl | LiOH |
| HBr | NaOH |
| Привет | КОН |
| HCIO 4 | РбОН |
| HNO 3 | CsOH |
| Са(ОН) 2 | |
| Sr(ОН) 2 | |
| Ва(ОН) 2 |
Нейтрализация сильной кислоты и сильного основания
Рассмотрим реакцию между \(\ce{HCl}\) и \(\ce{NaOH}\) в воде:
\[\underset{acid}{HCl( водн. )} + \underset{основа}{NaOH_{(водн.)}} \leftrightharpoons \underset{соль}{NaCl_{(водн.)}} + \underset{вода}{H_2O_{(l)}}\] 9+_{4 (водн.)} \)
)} + \underset{основа}{NaOH_{(водн.)}} \leftrightharpoons \underset{соль}{NaCl_{(водн.)}} + \underset{вода}{H_2O_{(l)}}\] 9+_{4 (водн.)} \)
Точка эквивалентности реакции нейтрализации наступает, когда и кислота, и основание в реакции полностью израсходованы, и ни один из них не находится в избытке. Когда сильная кислота нейтрализует слабое основание, pH полученного раствора будет меньше 7. Когда сильное основание нейтрализует слабую кислоту, pH полученного раствора будет больше 7.
| Сила кислоты и основания | Уровень pH |
|---|---|
| Сильная кислота-сильное основание | 7 |
| Сильное кислотно-слабое основание | <7 |
| Слабокислотно-сильное основание | >7 |
| Слабокислотно-слабое основание | pH <7, если \(K_a > K_b\) pH =7, если \(K_a = K_b\) pH >7, если \(K_a< K_b\) |
Титрование
Одним из наиболее распространенных и широко используемых способов завершения реакции нейтрализации является титрование. При титровании кислота или основание находятся в колбе или химическом стакане. Мы покажем два примера титрования. Первым будет титрование кислоты основанием. Вторым будет титрование основания кислотой.
При титровании кислота или основание находятся в колбе или химическом стакане. Мы покажем два примера титрования. Первым будет титрование кислоты основанием. Вторым будет титрование основания кислотой.
Пример \(\PageIndex{1}\): Титрование слабой кислоты
Предположим, 13,00 мл слабой кислоты с молярностью 0,1 М титруют 0,1 М раствором NaOH. Как бы мы начертили эту кривую титрования?
Решение
Шаг 1: Во-первых, нам нужно выяснить, где начинается наша кривая титрования. Для этого мы находим начальный рН слабой кислоты в стакане перед добавлением NaOH. Это точка, с которой начинается наша кривая титрования. Чтобы найти начальный рН, нам сначала нужна концентрация H 3 O + .
Настройте таблицу ICE для определения концентрации h4O+:
| \(НХ\) | 9-\)||||
|---|---|---|---|---|
| Начальный | 0,1М | |||
| Смена | -хМ | +хМ | +хМ | |
| Равновесие | (0,1-х)М | 9+]=-\log_{10}(0,023)=1,64\] |
Для расчета pH при 50% нейтрализации используйте приближение Хендерсона-Хассельбаха.
pH=pKa+log[ммоль основания/ммоль кислоты]
pH=pKa+ log[0,65 ммоль/0,65 ммоль]
pH=pKa+log(1)
\[pH=pKa\]
Следовательно, когда слабая кислота нейтрализована на 50%, pH=pKa
Шаг 3: Определите значение pH в точке эквивалентности.
Концентрация слабой кислоты составляет половину ее первоначальной концентрации после завершения нейтрализации 0,1M/2=0,05M HX
Настройте таблицу ICE для определения концентрации OH-:
| \(НХ\) | \(H_2O\) 9-\) | |||
|---|---|---|---|---|
| Начальный | 0,05 М | |||
| Смена | -х М | +х М | +х М | |
| Равновесие | 0,05-х М | 9-\) | ||
| Начальный | 1 ммоль | |||
| Добавлена база | 1,4 ммоль | |||
| Изменить | -1 ммоль | -1 ммоль | 1 ммоль | |
| Равновесие | 0 ммоль | 0,4 ммоль | 1 ммоль |
\[[OH-]=\frac{0,4\;ммоль}{10\;мл+14\;мл}=0,17\;M\]
\[pOH=-log_{10}(0,17 )=1,8\]
\[pH=14-1,8=12,2\]
Теперь мы собрали достаточно информации для построения нашей кривой титрования.
Пример \(\PageIndex{1}\)
В этом случае мы будем говорить, что раствор основания находится в колбе Эрленмейера. Чтобы нейтрализовать этот щелочной раствор, вы должны добавить в колбу раствор кислоты из бюретки. В начале титрования, перед добавлением какой-либо кислоты, необходимо добавить индикатор, чтобы изменение цвета сигнализировало о достижении точки эквивалентности.
Мы можем использовать точку эквивалентности, чтобы найти молярность и наоборот. Например, если мы знаем, что для нейтрализации 15 мл 0,0853 М раствора NaOH требуется 10,5 мл неизвестного раствора, мы можем найти молярность неизвестного раствора по следующей формуле:
\[M_1V_1 = M_2V_2\]
где M 1 молярность первого раствора, V 1 объем в литрах первого раствора, 99288 39033 3 молярность второго раствора, а V 2 – объем второго раствора в литрах. Когда мы подставляем данные нам значения в задачу, мы получаем уравнение, которое выглядит следующим образом:
\[(0,0835)(0,015) = M_2(0,0105)\] 9- + h3O_{(l)}\)
2. Сколько мл раствора 0,0955 М Ba(OH) 2 требуется для титрования 45,00 мл 0,0452 М HNO 3 ?
Сколько мл раствора 0,0955 М Ba(OH) 2 требуется для титрования 45,00 мл 0,0452 М HNO 3 ?
3. Будет ли pH раствора соли, образующегося в результате следующей химической реакции, больше, меньше или равен семи?
\(NaOH + H_2SO_4 \leftrightharpoons H_2O + NaSO_4\)
4. Мы знаем, что для нейтрализации 25,00 мл 0,135 М раствора КОН требуется 31,00 мл неизвестного раствора. Какова молярность неизвестного раствора? 9—\). Глядя на приведенную выше диаграмму, мы видим, что когда сильное основание нейтрализует слабую кислоту, уровень pH будет больше, чем 7 .
2. Подставив числа, данные в задаче, в уравнение:
\[M_1V_1= M_2V_2\]
, мы можем найти \(V_2\).
\[V_2= \dfrac{M_1V_1}{M_2} = \dfrac{(0,0452)(0,045)}{0,0955} = 21,2\; мл\]
Следовательно, для титрования 45,00 мл \(HNO_3\) требуется 21,2 мл \(Ba(OH)_2\).
3. Мы знаем, что NaOH — сильное основание, а H 2 SO 4 — сильная кислота.

 Если концентрация щелочи высока, то болевой симптом приводит к исступлению человека, он перестает разумно мыслить и порой даже не в состоянии вызвать медиков;
Если концентрация щелочи высока, то болевой симптом приводит к исступлению человека, он перестает разумно мыслить и порой даже не в состоянии вызвать медиков; 30
30
 -\)»>
-\)»>