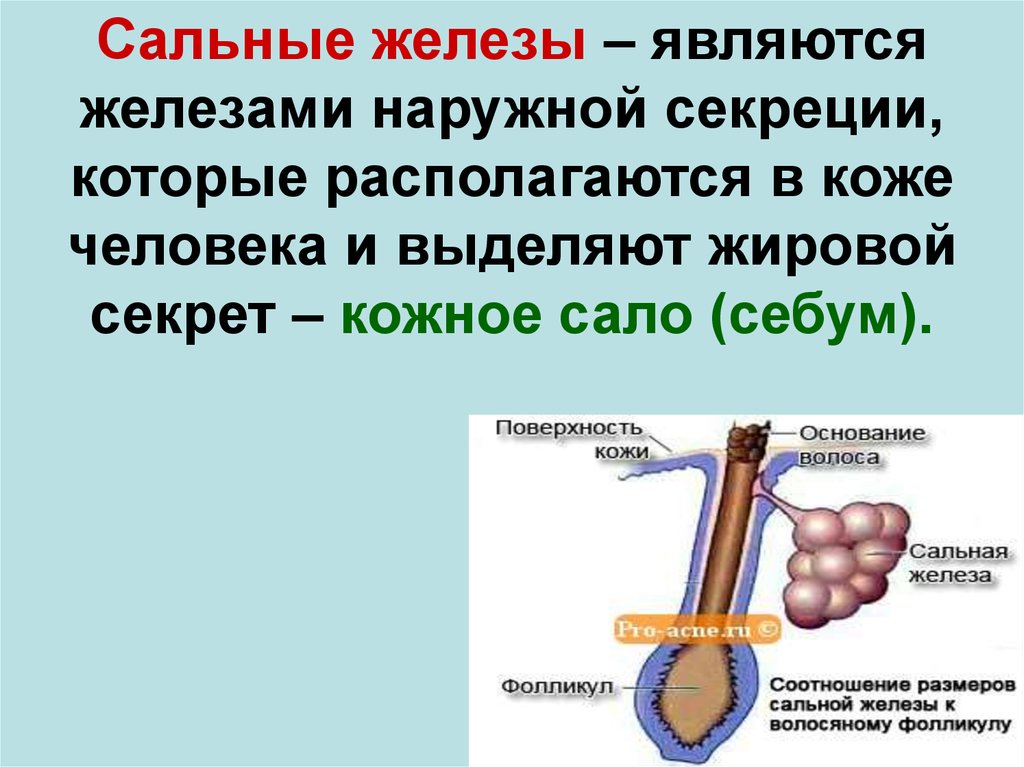
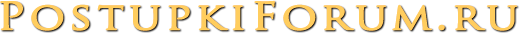Функции сальных желез
04.10.2021
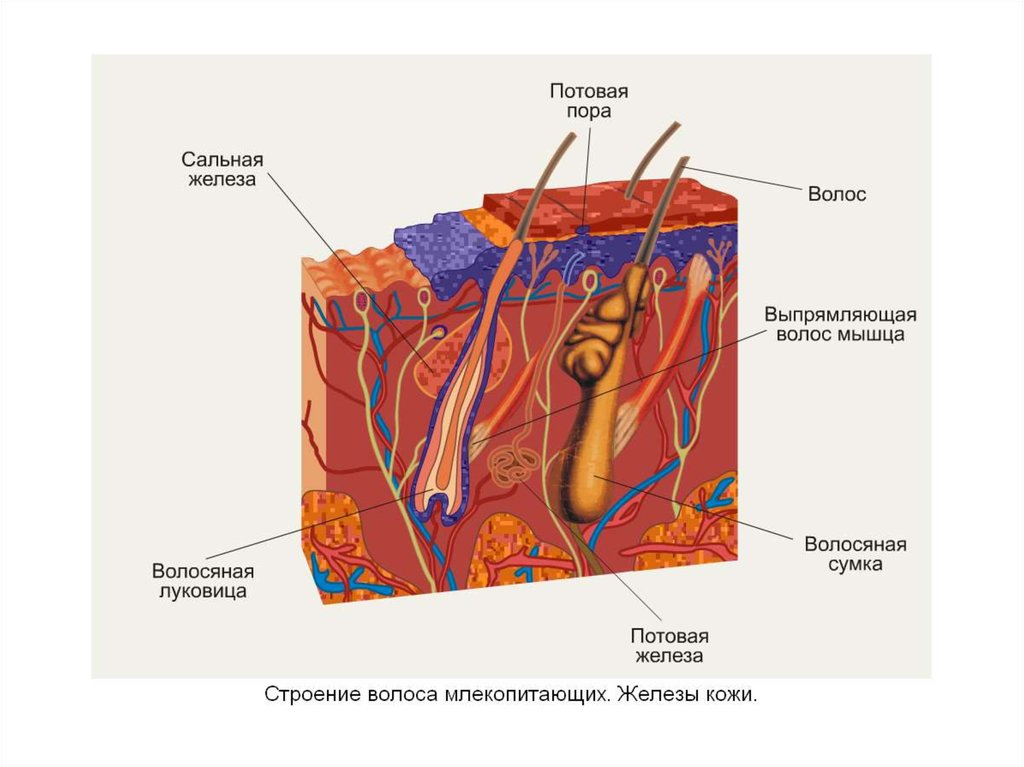
Сальные железы отвечают за выработку кожного сала, которое происходит практически на всей поверхности кожи. Они входят в так называемые прямые, разветвленные и пузырчатые железы. В основном они состоят из многослойного эпителия. Их самая важная задача — производить кожный жир, который попадает в волосяной фолликул. Именно кожный жир защищает кожу и волосы, питает их и обеспечивает надлежащее увлажнение. Кроме того, он защищает от развития грибковых или бактериальных инфекций.
Из чего состоит кожный жир?
Прежде всего, это смесь липидов эпителия, средний ее состав:
- глицериды (около 50%),
- воски (около 20 процентов),
- сквален (около 10 процентов),
- углеводороды (около 5%),
- свободные жирные кислоты (около 5%),
- сложные эфиры холестерина (около 4 процентов),
- другие стерины (около 1%),
- другие вещества (около 4%).
Сальные железы обычно расположены вокруг стержня волоса. Однако мы не найдем их вокруг губ, сосков или наружных половых органов. Подсчитано, что они занимают от 100 до 800 желез на одном сантиметре волосистой кожи.
Однако мы не найдем их вокруг губ, сосков или наружных половых органов. Подсчитано, что они занимают от 100 до 800 желез на одном сантиметре волосистой кожи.
Причины активной работы сальных желез
Хотя кожный жир необходим для правильного функционирования кожи, иногда железы вырабатывают слишком много кожного сала. Повышенная активность сальных желез и, как следствие, избыток кожного сала чаще всего связаны с гормональными нарушениями. Они могут появиться в подростковом возрасте, а у взрослых избыток кожного сала и, как следствие, образование непривлекательных прыщиков или черных точек на коже могут быть симптомом проблем со щитовидной железой, реакцией на длительный стресс или нездоровое питание.
Образование прыщей связано с закупоркой сальных желез. Под кожей начинает скапливаться пробка, преграждая ей выход. Он состоит из кожного сала, омертвевшего и мозолистого эпидермиса. Зачем они создаются? Для этого может быть несколько причин. Иногда мы говорим о генетических факторах, а иногда виноват состав кожного сала. Содержащиеся в нем жирные кислоты активируют гиперкератоз эпидермиса, что приводит к закупорке железы и появлению прыщей в виде черных точек, прыщиков или гнойных образований. Акне усугубится, если больной захочет бороться с ним с помощью андрогенов или подвергнет кожу воздействию солнца. Вы должны знать, что вера в то, что солнечные ванны помогают от прыщей, — это миф.
Иногда мы говорим о генетических факторах, а иногда виноват состав кожного сала. Содержащиеся в нем жирные кислоты активируют гиперкератоз эпидермиса, что приводит к закупорке железы и появлению прыщей в виде черных точек, прыщиков или гнойных образований. Акне усугубится, если больной захочет бороться с ним с помощью андрогенов или подвергнет кожу воздействию солнца. Вы должны знать, что вера в то, что солнечные ванны помогают от прыщей, — это миф.
Из-за чрезмерного пребывания на солнце кожа вырабатывает еще больше кожного сала под воздействием высокой температуры. И даже если солнце его высушит, он останется под кожей, а осенью появится на ее поверхности в виде прыщей. На начальной стадии развития прыщей на коже видны черные точки. Более крупные и трудно поддающиеся лечению поражения начинают появляться при бактериальной инфекции. Обычно они вызываются патогенами, которые естественным образом встречаются на коже (Propionibacterium acnes и Propionibacterium granulosum).
Попадание бактерий в сальные железы вызывает их опухание, а на поверхности кожи появляется красный болезненный комок, который со временем превращается в пустулу, заполненную гнойным отделяемым. По мнению специалистов, вручную такие изменения лучше не снимать, т.е. не выдавливать. К сожалению, многие люди игнорируют эти рекомендации и борются с ними самостоятельно, и это очень часто вызывает обесцвечивание или шрамы, от которых потом очень сложно избавиться. Чтобы избежать проблем, сходите к дерматологу и вылечите прыщи и стабилизируйте работу сальных желез.
Тип кожи и избыток кожного сала
Избыток кожного сала — характерная черта так называемого жирная кожа. Большая часть кожного сала появляется в основном на лбу, носу и подбородке, т. е Т-зона на лице. Обычно за это отвечают гены, но не только это. У некоторых людей перепроизводство кожного сала связано с неправильным уходом и гигиеной кожи лица, а иногда и с его полным отсутствием. Чтобы контролировать кожный жир, стоит позаботиться о правильном очищении и увлажнении кожи. Использование сильно подсыхающих препаратов может только усугубить проблему. Людям, у которых есть проблемы с избытком кожного жира и которые не знают, как ухаживать за своей кожей, следует проконсультироваться с дерматологом или хорошим косметологом.
Чтобы контролировать кожный жир, стоит позаботиться о правильном очищении и увлажнении кожи. Использование сильно подсыхающих препаратов может только усугубить проблему. Людям, у которых есть проблемы с избытком кожного жира и которые не знают, как ухаживать за своей кожей, следует проконсультироваться с дерматологом или хорошим косметологом.
Кроме того, особенно женщинам следует помнить, что нельзя наносить на кожу слишком толстый слой пудры или жидкости. Коже также нужен воздух для правильного функционирования, если все ее поры и железы забиты косметикой, она не сможет дышать, и это приведет к тому, что она начнет вырабатывать еще больше кожного жира, и на коже будут появляться все больше и больше неприглядных изменений. лицо. Если макияж необходим, то лучше выбрать самую натуральную косметику, а при необходимости стереть излишки кожного жира с лица специальными салфетками, которые не стирают с лица макияж.
Опубликовано в Дерматология Премиум Клиник
Строение и функции сальных желез
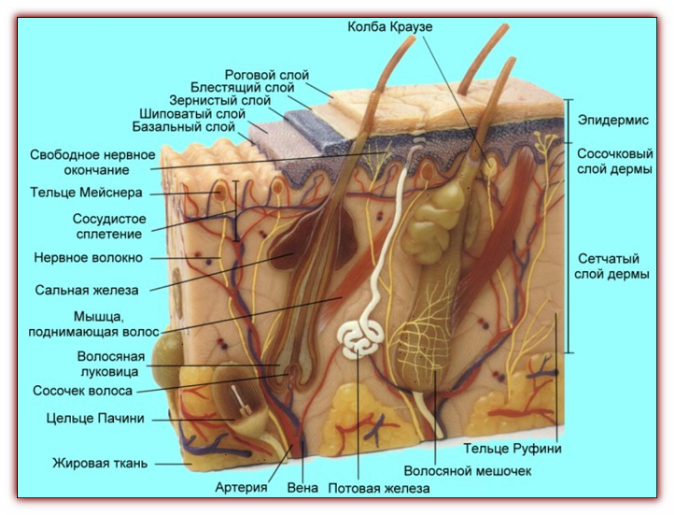
Сальные железы являются производными, или придатками кожи. Они впервые были описаны анатомом Malpighi в 1689 г. Располагаются практически на всех участках кожного покрова, за исключением ладоней, подошв и тыла стоп. В подавляющем большинстве протоки сальных желез открываются в устья волосяных фолликулов длинных, щетинистых или пушковых волос. При этом собственно сальная железа располагается у корня волоса на границе сетчатого и сосочкового слоев дермы. Кроме того, сальные железы располагаются изолированно на следующих участках кожного покрова: области носа, лба, подбородка, углов глаз, краев век (железы хрящевого края век — мейбомиевые железы), красной каймы губ, места перехода кожи в слизистую оболочку носа, нижней трети прямой кишки, кожи сосков и периареолярной области грудных желез, головки полового члена и внутреннего листка крайней плоти (тизониевы железы), а также на малых половых губах и клиторе.
Они впервые были описаны анатомом Malpighi в 1689 г. Располагаются практически на всех участках кожного покрова, за исключением ладоней, подошв и тыла стоп. В подавляющем большинстве протоки сальных желез открываются в устья волосяных фолликулов длинных, щетинистых или пушковых волос. При этом собственно сальная железа располагается у корня волоса на границе сетчатого и сосочкового слоев дермы. Кроме того, сальные железы располагаются изолированно на следующих участках кожного покрова: области носа, лба, подбородка, углов глаз, краев век (железы хрящевого края век — мейбомиевые железы), красной каймы губ, места перехода кожи в слизистую оболочку носа, нижней трети прямой кишки, кожи сосков и периареолярной области грудных желез, головки полового члена и внутреннего листка крайней плоти (тизониевы железы), а также на малых половых губах и клиторе.
Количество сальных желез на различных участках поверхности тела неодинаково. Так, например, в области тыла кистей, кожи голеней и на красной кайме губ их мало.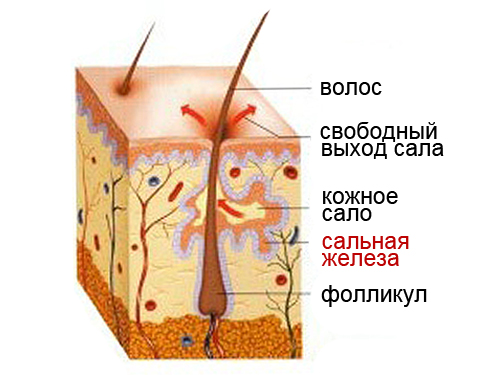 Напротив, в области лба, надбровий, носогубного треугольника, подбородка (так называемая Т-зона), на волосистой части головы, а также в области ушных раковин, средней линии груди и в межлопаточной области спины число сальных желез велико и достигает 400-900 на квадратный сантиметр. Именно эти места большого скопления сальных желез поражаются при себорее — состоянии, при котором усилена секреция кожного сала. Большое количество сальных желез присутствует также в подмышечных впадинах, перианально и перигенитально. Там они анатомически связаны не только с волосяными фолликулами, но и с апокринными потовыми железами. Поэтому при их закупорке и воспалении возникает одна из тяжелых форм акне — суппуративный гидраденит, или инверсные акне. Указанные зоны с большим количеством сальных желез принято называть себорейными.
Напротив, в области лба, надбровий, носогубного треугольника, подбородка (так называемая Т-зона), на волосистой части головы, а также в области ушных раковин, средней линии груди и в межлопаточной области спины число сальных желез велико и достигает 400-900 на квадратный сантиметр. Именно эти места большого скопления сальных желез поражаются при себорее — состоянии, при котором усилена секреция кожного сала. Большое количество сальных желез присутствует также в подмышечных впадинах, перианально и перигенитально. Там они анатомически связаны не только с волосяными фолликулами, но и с апокринными потовыми железами. Поэтому при их закупорке и воспалении возникает одна из тяжелых форм акне — суппуративный гидраденит, или инверсные акне. Указанные зоны с большим количеством сальных желез принято называть себорейными.
Сальные железы относят к простым альвеолярным железам с разветвленными концевыми отделами и выводными протоками. Концевые отделы образованы несколькими альвеолами (мешочками, дольками, ацинусами), состоящими из многослойного эпителия, в котором имеются клетки двух типов: базальные клетки и себоциты. Базальные клетки лежат на базальной мембране и образуют периферический, или ростковый слой концевого отдела железы. Себоциты мигрируют из базального слоя и дифференцируются. Эти клетки выполняют секреторную функцию, в них накапливаются в виде крупных включений липиды; в дальнейшем себоциты смещаются в направлении протока железы, распадаются и превращаются в секрет — кожное сало. Тип секреции, при котором клетка-продуцент липидов полностью погибает и формируется секрет железы, называется голокриновым, или голокринным. Следовательно, сальные железы являются типичными представителями голокринного типа секреции. Каждый концевой отдел имеет свой выводной проток, которые объединяются в общий; он выходит в волосяной фолликул. Широкий и короткий общий выводной проток выстлан многослойным плоским ороговевающим эпителием.
Базальные клетки лежат на базальной мембране и образуют периферический, или ростковый слой концевого отдела железы. Себоциты мигрируют из базального слоя и дифференцируются. Эти клетки выполняют секреторную функцию, в них накапливаются в виде крупных включений липиды; в дальнейшем себоциты смещаются в направлении протока железы, распадаются и превращаются в секрет — кожное сало. Тип секреции, при котором клетка-продуцент липидов полностью погибает и формируется секрет железы, называется голокриновым, или голокринным. Следовательно, сальные железы являются типичными представителями голокринного типа секреции. Каждый концевой отдел имеет свой выводной проток, которые объединяются в общий; он выходит в волосяной фолликул. Широкий и короткий общий выводной проток выстлан многослойным плоским ороговевающим эпителием.
Сально-волосяные фолликулы и обособленно расположенные сальные железы обильно снабжаются кровью от поверхностного и глубокого дермальных сплетений. Данное обстоятельство имеет важное значение, поскольку с секретом сальных желез выделяются различные продукты метаболизма, а также токсиеские и некоторые лекарственные вещества (например, препараты йода, хлора, брома и др. ), поступающие из крови.
), поступающие из крови.
Иннервация сальных желез осуществляется сложным нервным сплетением, окружающим сальные железы, волосяные фолликулы, а также потовые железы. В состав этих сплетений входят волокна вегетативной нервной системы.
На различных участках кожного покрова сальные железы имеют неодинаковую величину. Обычно наиболее мелкие сальные железы связаны с фолликулами длинных волос, а крупные и многодольчатые — с фолликулами пушковых. Значительную величину имеют многодольчатые сальные железы в себорейных зонах. Довольно крупные размеры они имеют на лобке, в области больших половых губ, а также по линии шва на коже полового члена. Кожа голеней, предплечий и тыльных поверхностей кистей снабжена мелкими одно- или двудольными сальными железами. Именно поэтому кожа в этих местах наиболее часто характеризуется повышенной сухостью.
В течение жизни сальные железы изменяют свои размеры. Так, они имеют сравнительно большую величину непосредственно после рождения и в первые месяцы жизни ребенка, а затем уменьшаются.
Сальные железы выделяют сложный по составу секрет, который называют кожным салом. У взрослого человека за одни сутки в среднем вырабатывается около 20 грамм кожного сала. Выделению секрета сальных желез на поверхность кожи способствует сокращение гладкой мышцы, поднимающей волос. А сами волосы также покрыты тонкой водно-липидной пленкой.
Кожное сало, выделяясь из секреторного отдела сальных желез, заполняет их выводные протоки, устья волосяных фолликулов и постепенно распределяется по бороздкам кожи, покрывая всю поверхность кожи слоем толщиной 7-10 мкм.
По своему химическому составу кожное сало представляет собой смесь липидов. В его состав входят в основном свободные и связанные (этерифицированные) жирные кислоты. Кроме того, в кожном сале обнаруживают в небольшом количестве углеводороды, многоатомные алкоголи, глицерин, холестерол и его эфиры, эфиры воска, сквален, фосфолипиды, каротин, а также метаболиты стероидных гормонов. Среди свободных жирных кислот обнаруживают все жирные кислоты с количеством атомов углерода от 1 до 22. В их число входят высшие и низшие жирные кислоты, насыщенные и ненасыщенные, с прямой и разветвленной цепью углеродных атомов.
В его состав входят в основном свободные и связанные (этерифицированные) жирные кислоты. Кроме того, в кожном сале обнаруживают в небольшом количестве углеводороды, многоатомные алкоголи, глицерин, холестерол и его эфиры, эфиры воска, сквален, фосфолипиды, каротин, а также метаболиты стероидных гормонов. Среди свободных жирных кислот обнаруживают все жирные кислоты с количеством атомов углерода от 1 до 22. В их число входят высшие и низшие жирные кислоты, насыщенные и ненасыщенные, с прямой и разветвленной цепью углеродных атомов.
Основную часть свободных жирных кислот составляют высшие жирные кислоты и их гомологи с 14 (миристиновая), 16 (пальмитиновая) и 18 (насыщенная — стеариновая и ненасыщенная — олеиновая) атомами углерода в цепи. Растворимые в воде низшие жирные кислоты (муравьиная, уксусная, пропионо- вая, масляная, валериановая, капроновая, энантовая, пеларгоновая, каприновая и ундециленовая) и их гомологи содержатся в кожном сале в незначительном количестве. При этом известно, что содержание свободных высших жирных кислот составляет 25% по отношению к весу кожного сала, а свободных низших жирных кислот всего — 5,5%.
Кожа как уникальная структура по праву сравнивается многими авторами с кирпичной стеной, где роль «кирпичей» выполняют корнеоциты (постклеточные структуры рогового слоя), а «цемента» — высокоспециализированные и уникально организованные межклеточные липиды. К таким липидам относят керамиды (от англ. ceramides), холестерол, жирные кислоты, а также фосфолипиды, гликосилкерамиды, свободные сфингоидные основания и сульфат холестерола. Указанные липиды формируют основной барьер для воды, препятствуя тем самым трансэпидермальной потере воды (transepidermal water loss — TEWL). Они также играют роль особого межклеточного цементирующего вещества, дающего прочность сцепления постклеточных структур рогового слоя и обеспечивающего целостность кожи. В настоящее время известно, что в роговом слое эпидермиса имеется шесть основных классов так называемых «свободных», не связанных с корнеоцитами, керамидов и два основных класса керамидов, ковалентно связанных с поверхностью корнеоцитов (классы А и В). Состав керамидов в роговом слое кожи у людей весьма вариабелен и зависит от расы, сопутствующих соматических заболеваний, возраста, окружающей среды и ряда других факторов. Керамиды имеют довольно сложное химическое строение. Большинство из них представляют собой длинные цепи сфингоидного основания с количеством атомов углерода от 16 до 22; реже они представлены дигидросфингозином, фитосфингозином и 6-гидро- ксисфингозином. Сфингоидные основания соединены с различными жирными кислотами (олеиновой, линолевой и др.), в том числе и со свободными низшими жирными кислотами, выполняющими ряд важных биологических функций. К функциям керамидов относят не только удержание воды в коже, но и регуляцию темпа десквамации, а также влияние на диффе- ренцировку кератиноцитов.
В настоящее время известно, что в роговом слое эпидермиса имеется шесть основных классов так называемых «свободных», не связанных с корнеоцитами, керамидов и два основных класса керамидов, ковалентно связанных с поверхностью корнеоцитов (классы А и В). Состав керамидов в роговом слое кожи у людей весьма вариабелен и зависит от расы, сопутствующих соматических заболеваний, возраста, окружающей среды и ряда других факторов. Керамиды имеют довольно сложное химическое строение. Большинство из них представляют собой длинные цепи сфингоидного основания с количеством атомов углерода от 16 до 22; реже они представлены дигидросфингозином, фитосфингозином и 6-гидро- ксисфингозином. Сфингоидные основания соединены с различными жирными кислотами (олеиновой, линолевой и др.), в том числе и со свободными низшими жирными кислотами, выполняющими ряд важных биологических функций. К функциям керамидов относят не только удержание воды в коже, но и регуляцию темпа десквамации, а также влияние на диффе- ренцировку кератиноцитов.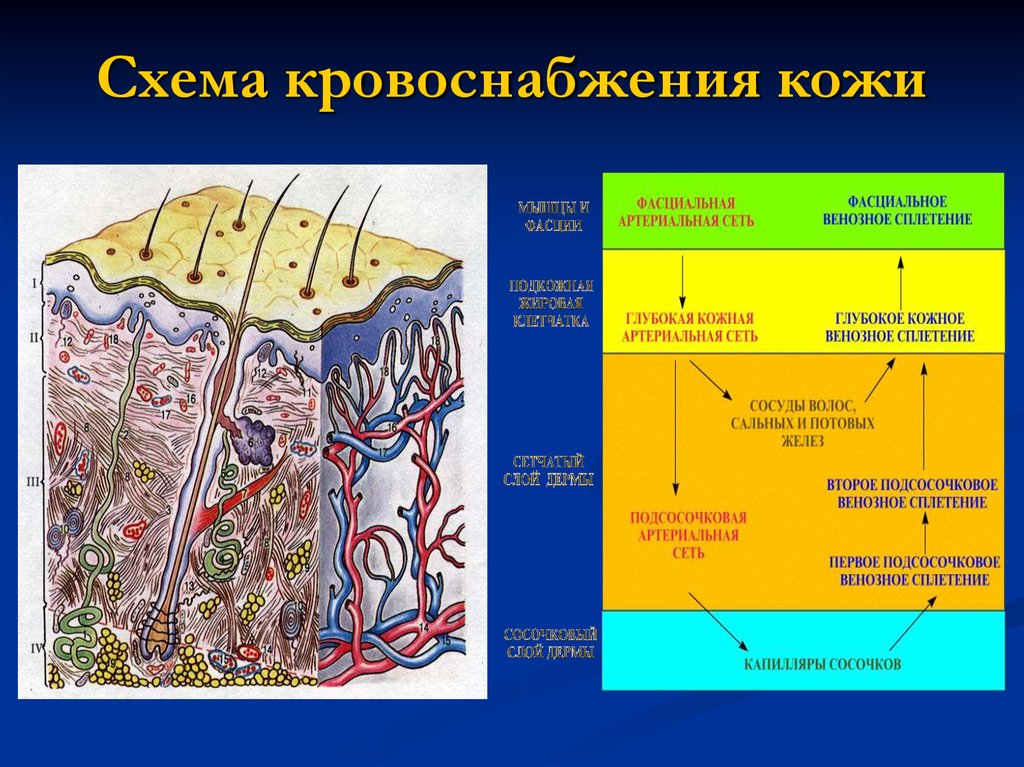
Секреция кожного сала регулируется в основном гормональными и в меньшей степени нейрогенными механизмами.
Гормональная регуляция секреции кожного сала осуществляется через андрогены, а именно, тестостероном, который является основным гормоном, усиливающим секрецию кожного сала. Именно к этому половому гормону имеются рецепторы на мембране клеток себоцитов. Взаимодействуя с рецептором на поверхности клетки, продуцирующей кожное сало, тестостерон под действием энзима 5-а-редуктазы преобразуется в свой активный метаболит — дегидротестостерон, который непосредственно увеличивает продукцию секрета. Было доказано, что сальные железы различной локализации имеют разное количество рецепторов к тестостерону. Этим объясняется тот факт, что у ряда пациентов нередко поражаются определенные зоны, например, только кожа в области подбородка или только кожа спины и т.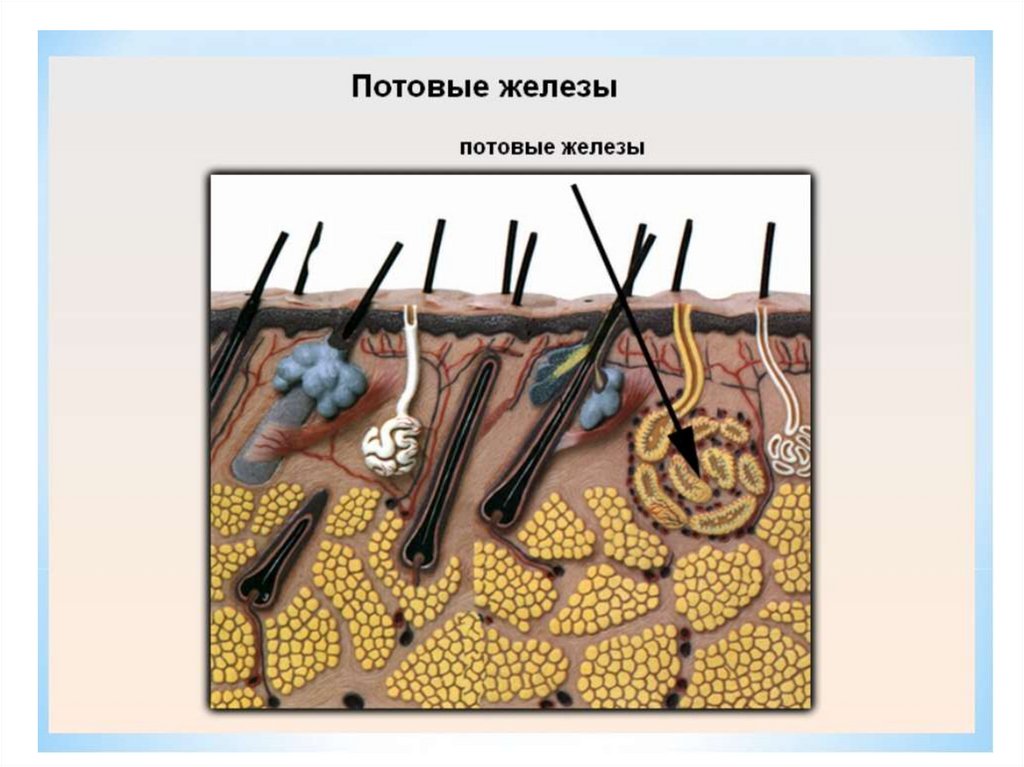 д. Количество биологически активного анд- рогена, как и чувствительность рецепторов себоцитов к нему, и активность 5-а-редуктазы, определяющие скорость секреции сальных желез, генетически детерминированы. В целом же, гормональная регуляция секреции кожного сала может осуществляться на четырех уровнях: гипоталамус, гипофиз, кора надпочечников и половые железы.
д. Количество биологически активного анд- рогена, как и чувствительность рецепторов себоцитов к нему, и активность 5-а-редуктазы, определяющие скорость секреции сальных желез, генетически детерминированы. В целом же, гормональная регуляция секреции кожного сала может осуществляться на четырех уровнях: гипоталамус, гипофиз, кора надпочечников и половые железы.
К гормонам, подавляющим салоотделение, относятся эстрогены, так как их преобладание приводит к уменьшению действия андрогенов. Однако подавляющий секрецию кожного сала эффект эстрогенов выражен значительно меньше, чем эффект андрогенов, которые стимулируют салоотделение.
Что касается нейрогенной регуляции секреции, то она в основном осуществляется вегетативной нервной системой. Усиленное салоотделение обнаруживают у лиц с ваготонией; при этом возможно появление и других симптомов повышенного тонуса вагуса — резко усиленной потливости, стойкого красного дермографизма, акроцианоза. Изменение тонуса вегетативной нервной системы, иннервирующей мышцы, поднимающие волос, приводит к более быстрому опорожнению кожного сала из сальных желез, связанных с волосяным фолликулом.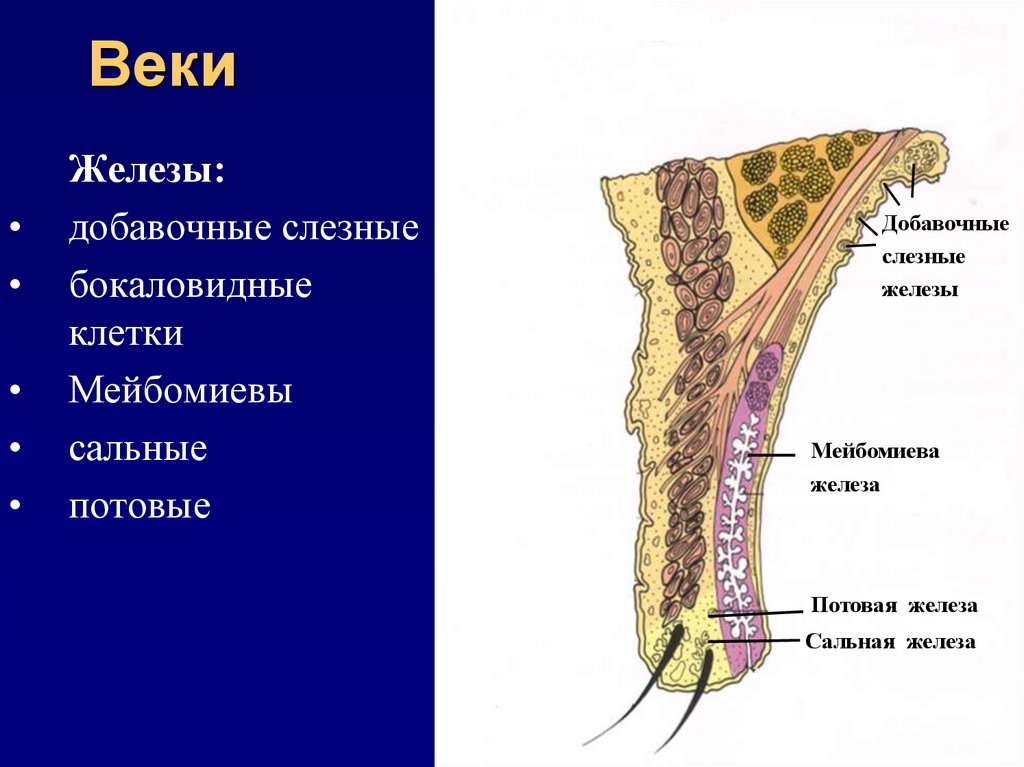 Считается, что не только вегетативная нервная система оказывает влияние на секрецию кожного сала. Известно также, что салоотделение отчетливо усиливается при различных поражениях коры головного мозга (инсульт) или при некоторых подкорковых нарушениях при энцефалите, паркинсонизме, диэнцефальных нарушениях, а также при поражении периферических нервов. Значительные нарушения салоотделения встречаются и у больных такими психическими заболеваниями, как шизофрения, маниакально-депрессивный и инфекционный психозы, эпилепсия, различные депрессивные состояния. По-видимому, во всех указанных состояниях более существенное значение имеют изменение выброса гормонов гипофиза и гипоталамуса и опосредованное действие на содержание тестостерона.
Считается, что не только вегетативная нервная система оказывает влияние на секрецию кожного сала. Известно также, что салоотделение отчетливо усиливается при различных поражениях коры головного мозга (инсульт) или при некоторых подкорковых нарушениях при энцефалите, паркинсонизме, диэнцефальных нарушениях, а также при поражении периферических нервов. Значительные нарушения салоотделения встречаются и у больных такими психическими заболеваниями, как шизофрения, маниакально-депрессивный и инфекционный психозы, эпилепсия, различные депрессивные состояния. По-видимому, во всех указанных состояниях более существенное значение имеют изменение выброса гормонов гипофиза и гипоталамуса и опосредованное действие на содержание тестостерона.
В заключение следует подчеркнуть биологическую роль сальных желез. Прежде всего, сальные железы выделяют кожное сало, которое входит в состав водно-липидной мантии кожи. Водно-липидная эмульсия, образующаяся на поверхности кожи, оказывает следующие воздействия:
-
Придает эластичность коже и препятствует ее пересушиванию.

-
Регулирует темпы десквамации и дифференцировку кератиноцитов.
-
Способствует поддержанию постоянной температуры тела за счет изменений физического состава водно-липидной мантии.
-
Нейтрализует щелочи, попадающие на поверхность кожи, органическими жирными кислотами и поддерживает постоянный слабо-кислый рН (4,5-5,5).
-
Подавляет размножение бактерий, грибов, вирусов благодаря свободным низшим жирным кислотам и некоторым другим веществам, входящим в состав кожного сала, пота и рогового слоя.
-
Является одним из путей экскреции различных продуктов обмена, а также лекарственных и токсических веществ.
Новые данные о роли сальных желез в патогенезе акне
1. Downing DT, Stewart ME, Wertz PW, et al. Липиды кожи: обновление. Джей Инвест Дерматол. 1987; 88: 2–6. [PubMed] [Google Scholar]
2. Тоди А. Дж., Шустер С. Контроль и функция сальных желез. Physiol Rev. 1989; 69: 1–4. [PubMed] [Google Scholar]
Дж., Шустер С. Контроль и функция сальных желез. Physiol Rev. 1989; 69: 1–4. [PubMed] [Google Scholar]
3. Nikkari T, Schreibman PH, Ahrens EH., Jr In vivo исследования секреции стерола и сквалена кожей человека. J липидный рез. 1974; 15: 563–573. [PubMed] [Академия Google]
4. Ramasastry P, Downing DT, Pochi PE, et al. Химический состав липидов поверхности кожи человека от рождения до полового созревания. Джей Инвест Дерматол. 1970; 54: 139–144. [PubMed] [Google Scholar]
5. Zouboulis CC. Работа прыщей и сальных желез. Клин Дерматол. 2004; 22: 360–366. [PubMed] [Google Scholar]
6. Zouboulis CC, Seltmann H, Neitzel H, et al. Создание и характеристика иммортализованной линии клеток сальных желез человека (SZ95) J Invest Dermatol. 1999;113:1011–1020. [PubMed] [Академия Google]
7. Thiboutot D, Jabara S, McAllister JM, et al. Кожа человека является стероидогенной тканью: стероидогенные ферменты и кофакторы экспрессируются в эпидермисе, нормальных себоцитах и клеточной линии иммортализованных себоцитов (SEB-1) J Invest Dermatol. 2003; 120:905–914. [PubMed] [Google Scholar]
2003; 120:905–914. [PubMed] [Google Scholar]
8. Lo Celso C, Berta MA, Braun KM, et al. Характеристика бипотенциальных эпидермальных предшественников, полученных из сальных желез человека: противоположные роли c-Myc и бета-катенина. Стволовые клетки. 2008; 26:1241–1252. [PubMed] [Академия Google]
9. Kurokawa I, Danby FW, Ju Q, et al. Новое в нашем понимании патогенеза и лечения акне. Опыт Дерматол. 2009; 18: 821–832. [PubMed] [Google Scholar]
10. Stewart ME. Липиды сальных желез. Семин Дерматол. 1992; 11: 100–105. [PubMed] [Google Scholar]
11. Downing DT, Stewart ME, Wertz PW, et al. Незаменимые жирные кислоты и прыщи. J Am Acad Дерматол. 1986; 14: 221–225. [PubMed] [Google Scholar]
12. Rasmussen JE. Диета и прыщи. Int J Дерматол. 1977;16:488–492. [PubMed] [Google Scholar]
13. Smith RN, Braue A, Varigos GA, et al. Влияние диеты с низкой гликемической нагрузкой на вульгарные угри и состав жирных кислот триглицеридов на поверхности кожи. J Дерматол Sci. 2008; 50:41–52. [PubMed] [Google Scholar]
J Дерматол Sci. 2008; 50:41–52. [PubMed] [Google Scholar]
14. Downing DT, Strauss JS, Pochi PE. Изменения липидного состава поверхности кожи, вызванные жестким ограничением калорийности у человека. Am J Clin Nutr. 1972; 25: 365–367. [PubMed] [Google Scholar]
15. Pochi PE, Downing DT, Strauss JS. Реакция сальных желез у человека на длительное полное голодание. Джей Инвест Дерматол. 1970;55:303–309. [PubMed] [Google Scholar]
16. Макдональд И. Изменения жирнокислотного состава кожного сала, связанные с диетами с высоким содержанием углеводов. Природа. 1964; 203: 1067–1068. [PubMed] [Google Scholar]
17. Мельник BC, Schmitz G. Роль инсулина, инсулиноподобного фактора роста-1, гипергликемической пищи и потребления молока в патогенезе вульгарных угрей. Опыт Дерматол. 2009; 18: 833–841. [PubMed] [Google Scholar]
18. Ottaviani M, Alestas T, Flori E, et al. Пероксидированный сквален индуцирует выработку медиаторов воспаления в кератиноцитах HaCaT: возможная роль в вульгарных угрях. Джей Инвест Дерматол. 2006;126:2430–2437. [PubMed] [Академия Google]
Джей Инвест Дерматол. 2006;126:2430–2437. [PubMed] [Академия Google]
19. Zouboulis CC, Schagen S, Alestas T. Культура себоцитов: модель для изучения патофизиологии сальных желез при себостазе, себорее и акне. Арка Дерматол Рез. 2008; 300:397–413. [PubMed] [Google Scholar]
20. Russell LE, Harrison WJ, Bahta AW, et al. Характеристика экспрессии и функции рецептора X печени в коже человека и сально-волосяной единице. Опыт Дерматол. 2007; 16: 844–852. [PubMed] [Google Scholar]
21. Hong I, Lee MH, Na TY, et al. LXRalpha усиливает синтез липидов в SZ95 себоцитов. Джей Инвест Дерматол. 2008; 128:1266–1272. [PubMed] [Google Scholar]
22. Baulieu EE, Thomas G, Legrain S, et al. Дегидроэпиандростерон (ДГЭА), сульфат ДГЭА и старение: вклад исследования DHEAge в социобиомедицинскую проблему. Proc Natl Acad Sci USA. 2000;97:4279–4284. [Бесплатная статья PMC] [PubMed] [Google Scholar]
23. Reichrath J, Mittmann M, Kamradt J, et al. Экспрессия рецепторов ретиноида-X (-альфа, -бета, -гамма) и рецепторов ретиноевой кислоты (-альфа, -бета, -гамма) в нормальной коже человека: иммуногистологическая оценка. Гистохим Дж. 1997;29:127–133. [PubMed] [Google Scholar]
Гистохим Дж. 1997;29:127–133. [PubMed] [Google Scholar]
24. Tsukada M, Schroder M, Roos TC, et al. 13-цис-ретиноевая кислота проявляет свою специфическую активность в отношении себоцитов человека посредством селективной внутриклеточной изомеризации в полностью транс-ретиноевую кислоту и связывания с рецепторами ретиноевой кислоты. Джей Инвест Дерматол. 2000; 115:321–327. [PubMed] [Google Scholar]
25. Zouboulis CC, Korge B, Akamatsu H, et al. Влияние 13-цис-ретиноевой кислоты, полностью транс-ретиноевой кислоты и ацитретина на пролиферацию, синтез липидов и экспрессию кератина культивируемых себоцитов человека in vitro. Джей Инвест Дерматол. 1991;96:792–797. [PubMed] [Google Scholar]
26. Kim MJ, Deplewski D, Ciletti N, et al. Ограниченное взаимодействие между рецепторами, активируемыми пролифератором пероксисом, и агонистами ретиноидных Х-рецепторов в росте и развитии себоцитов. Мол Жене Метаб. 2001; 74: 362–369. [PubMed] [Google Scholar]
27. Kramer C, Seltmann H, Seifert M, et al. Характеристика эндокринной системы витамина D в себоцитах человека in vitro. J Steroid Biochem Mol Biol. 2009; 113:9–16. [PubMed] [Академия Google]
Характеристика эндокринной системы витамина D в себоцитах человека in vitro. J Steroid Biochem Mol Biol. 2009; 113:9–16. [PubMed] [Академия Google]
28. Сато Т., Имаи Н., Акимото Н. и др. Эпидермальный фактор роста и 1альфа,25-дигидроксивитамин D3 подавляют липогенез в клетках сальных желез хомяка in vitro. Джей Инвест Дерматол. 2001; 117: 965–970. [PubMed] [Google Scholar]
29. Sansone G, Reisner RM. Различная скорость превращения тестостерона в дигидротестостерон при акне и в нормальной коже человека — возможный патогенный фактор акне. Джей Инвест Дерматол. 1971; 56: 366–372. [PubMed] [Google Scholar]
30. Pochi PE, Strauss JS. Реакция сальных желез у человека на введение тестостерона, дельта-4-андростендиона и дегидроизоандростерона. Джей Инвест Дерматол. 1969;52:32–36. [PubMed] [Google Scholar]
31. Giltay EJ, Gooren LJ. Влияние лишения/введения половых стероидов на рост волос и выработку кожного сала у транссексуальных мужчин и женщин. J Clin Endocrinol Metab.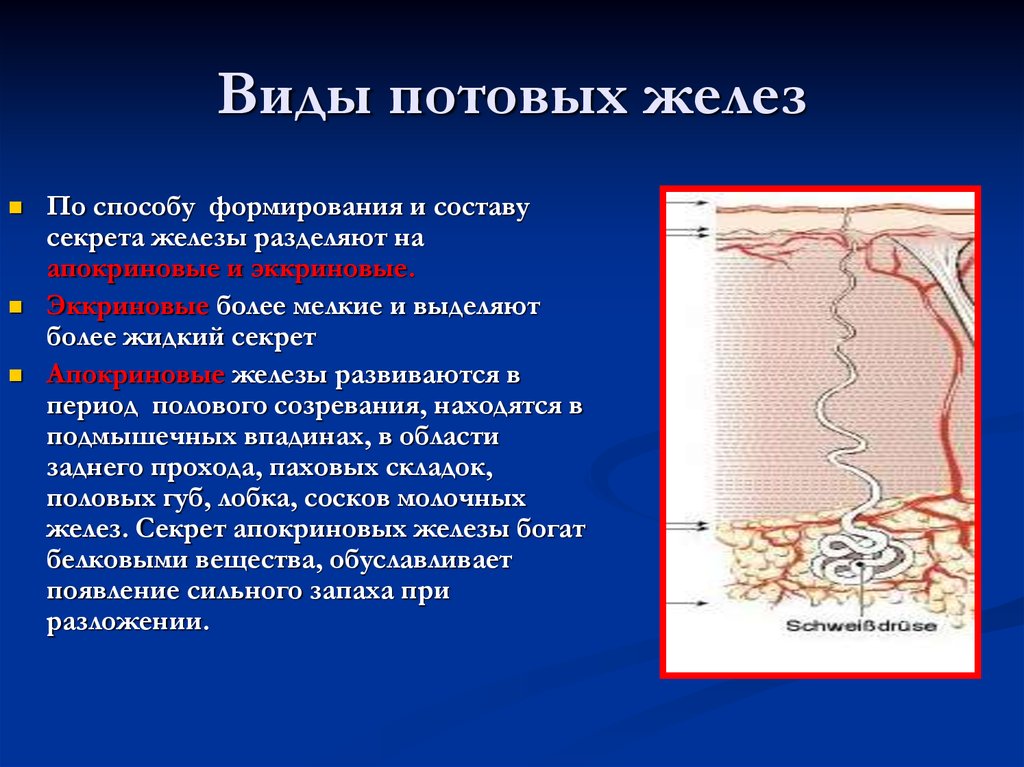 2000; 85: 2913–2921. [PubMed] [Google Scholar]
2000; 85: 2913–2921. [PubMed] [Google Scholar]
32. Orfanos CE, Adler YD, Zouboulis CC. Синдром САХА. Горм Рез. 2000; 54: 251–258. [PubMed] [Google Scholar]
33. Fritsch M, Orfanos CE, Zouboulis CC. Себоциты являются ключевыми регуляторами гомеостаза андрогенов в коже человека. Джей Инвест Дерматол. 2001;116:793–800. [PubMed] [Google Scholar]
34. Chen W, Zouboulis CC, Fritsch M, et al. Гетерогенность и количественные различия экспрессии 5-альфа-редуктазы типа 1 в культивируемых эпителиальных клетках кожи. Дерматология. 1998; 196: 51–52. [PubMed] [Google Scholar]
35. Fimmel S, Saborowski A, Orfanos CE, et al. Разработка эффективных систем транзиентной трансфекции для введения антисмысловых олигонуклеотидов в эпителиальные клетки кожи человека. Горм Рез. 2000;54:306–311. [PubMed] [Академия Google]
36. Андерсон К.М., Ляо С. Селективное удержание дигидротестостерона ядрами предстательной железы. Природа. 1968; 219: 277–279. [PubMed] [Google Scholar]
37. Akamatsu H, Zouboulis CC, Orfanos CE. Контроль пролиферации себоцитов человека in vitro с помощью тестостерона и 5-альфа-дигидротестостерона зависит от локализации сальных желез. Джей Инвест Дерматол. 1992; 99: 509–511. [PubMed] [Google Scholar]
Akamatsu H, Zouboulis CC, Orfanos CE. Контроль пролиферации себоцитов человека in vitro с помощью тестостерона и 5-альфа-дигидротестостерона зависит от локализации сальных желез. Джей Инвест Дерматол. 1992; 99: 509–511. [PubMed] [Google Scholar]
38. Rosenfield RL, Deplewski D, Kentsis A, et al. Механизмы индукции андрогенами дифференцировки себоцитов. Дерматология. 1998;196:43–46. [PubMed] [Google Scholar]
39. Chen W, Yang CC, Sheu HM, et al. Экспрессия рецептора, активируемого пролифератором пероксисом, и транскрипционных факторов, связывающих белок CCAAT/энхансер, в культивируемых себоцитах человека. Джей Инвест Дерматол. 2003; 121:441–447. [PubMed] [Google Scholar]
40. Zouboulis CC, Eady A, Philpott M, et al. Каков патогенез акне? Опыт Дерматол. 2005; 14: 143–152. [PubMed] [Google Scholar]
41. Alestas T, Ganceviciene R, Fimmel S, et al. Ферменты, участвующие в биосинтезе лейкотриена В(4) и простагландина Е(2), активны в сальных железах. Дж. Мол Мед. 2006; 84: 75–87. [PubMed] [Академия Google]
2006; 84: 75–87. [PubMed] [Академия Google]
42. Minghetti P, Cilurzo F, Casiraghi A, et al. Разработка пластырей для контролируемого высвобождения дегидроэпиандростерона. Фарминдустрия разработки лекарственных средств. 2001; 27: 711–717. [PubMed] [Google Scholar]
43. Shin MH, Rhie GE, Park CH, et al. Модуляция метаболизма коллагена путем местного нанесения дегидроэпиандростерона на кожу человека. Джей Инвест Дерматол. 2005; 124:315–323. [PubMed] [Google Scholar]
44. Deplewski D, Rosenfield RL. Роль гормонов в развитии сальных желез. Эндокр, ред. 2000; 21:363–39.2. [PubMed] [Google Scholar]
45. Burton JL, Libman LJ, Cunliffe WJ, et al. Выделение кожного сала при акромегалии. Br Med J. 1972; 1: 406–408. [Бесплатная статья PMC] [PubMed] [Google Scholar]
46. Makrantonaki E, Vogel K, Fimmel S, et al. Взаимодействие IGF-I и 17бета-эстрадиола на возрастных уровнях в себоцитах и фибробластах человека in vitro. Опыт Геронтол. 2008;43:939–946. [PubMed] [Google Scholar]
47. Deplewski D, Rosenfield RL. Гормон роста и инсулиноподобные факторы роста по-разному влияют на рост и дифференцировку сальных клеток. Эндокринология. 1999;140:4089–4094. [PubMed] [Google Scholar]
Deplewski D, Rosenfield RL. Гормон роста и инсулиноподобные факторы роста по-разному влияют на рост и дифференцировку сальных клеток. Эндокринология. 1999;140:4089–4094. [PubMed] [Google Scholar]
48. Ikawa A, Ishii Y, Suzuki K, et al. Возрастные изменения гистологии кожи спины у крыс Mini и Wistar. Гистол Гистопатол. 2002; 17: 419–426. [PubMed] [Google Scholar]
49. Aizawa H, Niimura M. Повышенный уровень инсулиноподобного фактора роста-1 (IGF-1) в сыворотке у женщин с акне постподросткового возраста. J Дерматол. 1995; 22: 249–252. [PubMed] [Google Scholar]
50. Cappel M, Mauger D, Thiboutot D. Корреляция между сывороточными уровнями инсулиноподобного фактора роста 1, дегидроэпиандростерона сульфата и дигидротестостерона и числом поражений акне у взрослых женщин. Арка Дерматол. 2005; 141:333–338. [PubMed] [Академия Google]
51. Вора С., Овхал А., Джераджани Х. и др. Корреляция кожного сала на лице с сывороточным инсулиноподобным фактором роста-1 у пациентов с акне. Бр Дж Дерматол. 2008; 159: 990–991. [PubMed] [Google Scholar]
Бр Дж Дерматол. 2008; 159: 990–991. [PubMed] [Google Scholar]
52. Hansson HA, Nilsson A, Isgaard J, et al. Иммуногистохимическая локализация инсулиноподобного фактора роста I у взрослой крысы. Гистохимия. 1988; 89: 403–410. [PubMed] [Google Scholar]
53. Rudman SM, Philpott MP, Thomas GA, et al. Роль IGF-I в коже человека и ее придатках: морфоген и митоген? Джей Инвест Дерматол. 1997;109:770–777. [PubMed] [Google Scholar]
54. Tavakkol A, Varani J, Elder JT, et al. Поддержание кожи человека в культуре органов: роль рецептора инсулиноподобного фактора роста-1 и рецептора эпидермального фактора роста. Арка Дерматол Рез. 1999; 291:643–651. [PubMed] [Google Scholar]
55. Smith TM, Cong Z, Gilliland KL, et al. Инсулиноподобный фактор роста-1 индуцирует выработку липидов в себоцитах SEB-1 человека через белок-1, связывающий элемент ответа на стерол. Джей Инвест Дерматол. 2006; 126:1226–1232. [PubMed] [Академия Google]
56. Smith TM, Gilliland K, Clawson GA, et al. IGF-1 индуцирует экспрессию SREBP-1 и липогенез в себоцитах SEB-1 посредством активации пути фосфоинозитид-3-киназы/Akt. Джей Инвест Дерматол. 2008; 128:1286–1293. [Бесплатная статья PMC] [PubMed] [Google Scholar]
IGF-1 индуцирует экспрессию SREBP-1 и липогенез в себоцитах SEB-1 посредством активации пути фосфоинозитид-3-киназы/Akt. Джей Инвест Дерматол. 2008; 128:1286–1293. [Бесплатная статья PMC] [PubMed] [Google Scholar]
57. Rosignoli C, Nicolas JC, Jomard A, et al. Участие пути SREBP в механизме действия андрогенов в сальных железах in vivo. Опыт Дерматол. 2003; 12: 480–489. [PubMed] [Google Scholar]
58. Makrantonaki E, Adjaye J, Herwig R, et al. Возрастное гормональное снижение сопровождается транскрипционными изменениями себоцитов человека in vitro. Стареющая клетка. 2006; 5: 331–344. [PubMed] [Академия Google]
59. Krause K, Schnitger A, Fimmel S, et al. Передача сигналов кортикотропин-высвобождающего гормона через кожу опосредована рецепторами и преобладает в сальных железах. Горм Метаб Рез. 2007; 39: 166–170. [PubMed] [Google Scholar]
60. Zouboulis CC, Seltmann H, Hiroi N, et al. Кортикотропин-рилизинг-гормон: аутокринный гормон, который способствует липогенезу в себоцитах человека. Proc Natl Acad Sci USA. 2002; 99: 7148–7153. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Proc Natl Acad Sci USA. 2002; 99: 7148–7153. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Ganceviciene R, Graziene V, Fimmel S, et al. Участие системы кортикотропин-рилизинг-гормона в патогенезе вульгарных угрей. Бр Дж Дерматол. 2009 г.;160:345–352. [PubMed] [Google Scholar]
62. Thody AJ, Cooper MF, Bowden PE, et al. Влияние альфа-меланоцитстимулирующего гормона и тестостерона на кожные и модифицированные сальные железы крысы. J Эндокринол. 1976; 71: 279–288. [PubMed] [Google Scholar]
63. Zhang L, Li WH, Anthonavage M, et al. Рецептор меланокортина-5: маркер дифференцировки себоцитов человека. Пептиды. 2006; 27: 413–420. [PubMed] [Google Scholar]
64. Bohm M, Schiller M, Stander S, et al. Доказательства экспрессии рецептора меланокортина-1 в себоцитах человека in vitro и in situ. Джей Инвест Дерматол. 2002; 118: 533–539.. [PubMed] [Google Scholar]
65. Ganceviciene R, Graziene V, Bohm M, et al. Увеличение in situ экспрессии рецептора меланокортина-1 в сальных железах пораженной кожи у пациентов с вульгарными угрями. Опыт Дерматол. 2007; 16: 547–552. [PubMed] [Google Scholar]
Опыт Дерматол. 2007; 16: 547–552. [PubMed] [Google Scholar]
66. Bhardwaj R, Becher E, Mahnke K, et al. Доказательства дифференциальной экспрессии функционального рецептора альфа-меланоцитстимулирующего гормона MC-1 на моноцитах человека. Дж Иммунол. 1997; 158:3378–3384. [PubMed] [Академия Google]
67. Hartmeyer M, Scholzen T, Becher E, et al. Эндотелиальные клетки кожных микрососудов человека экспрессируют меланокортиновый рецептор типа 1 и продуцируют повышенные уровни IL-8 при стимуляции альфа-меланоцитстимулирующим гормоном. Дж Иммунол. 1997; 159: 1930–1937. [PubMed] [Google Scholar]
68. Jeremy AH, Holland DB, Roberts SG, et al. Воспалительные события вовлечены в инициирование акне. Джей Инвест Дерматол. 2003; 121:20–27. [PubMed] [Google Scholar]
69. Stander S, Schmelz M, Metze D, et al. Распределение каннабиноидных рецепторов 1 (CB1) и 2 (CB2) на сенсорных нервных волокнах и придаточных структурах кожи человека. J Дерматол Sci. 2005; 38: 177–188. [PubMed] [Академия Google]
70. Доброси Н., Тот Б.И., Надь Г. и соавт. Эндоканнабиноиды усиливают синтез липидов и апоптоз себоцитов человека посредством передачи сигналов, опосредованной каннабиноидным рецептором-2. Фасеб Дж. 2008; 22:3685–3695. [PubMed] [Google Scholar]
Доброси Н., Тот Б.И., Надь Г. и соавт. Эндоканнабиноиды усиливают синтез липидов и апоптоз себоцитов человека посредством передачи сигналов, опосредованной каннабиноидным рецептором-2. Фасеб Дж. 2008; 22:3685–3695. [PubMed] [Google Scholar]
71. Тойода М., Накамура М., Морохаши М. Нейропептиды и сальные железы. Евр Дж Дерматол. 2002; 12: 422–427. [PubMed] [Google Scholar]
72. Thielitz A, Reinhold D, Vetter R, et al. Ингибиторы дипептидилпептидазы IV и аминопептидазы N воздействуют на основные этапы патогенеза возникновения акне. Джей Инвест Дерматол. 2007; 127:1042–1051. [PubMed] [Академия Google]
73. Toth BI, Geczy T, Griger Z, et al. Временный рецепторный потенциал передачи сигналов ваниллоида-1 как регулятора биологии себоцитов человека. Джей Инвест Дерматол. 2009; 129: 329–339. [PubMed] [Google Scholar]
74. Zouboulis CC. Являются ли вульгарные угри настоящим воспалительным заболеванием? Дерматология. 2001; 203: 277–279. [PubMed] [Google Scholar]
75. Freedberg IM, Tomic-Canic M, Komine M, et al. Кератины и цикл активации кератиноцитов. Джей Инвест Дерматол. 2001; 116: 633–640. [PubMed] [Академия Google]
Freedberg IM, Tomic-Canic M, Komine M, et al. Кератины и цикл активации кератиноцитов. Джей Инвест Дерматол. 2001; 116: 633–640. [PubMed] [Академия Google]
76. Trivedi NR, Gilliland KL, Zhao W, et al. Профилирование экспрессии массива генов при поражениях акне выявляет заметную активацию генов, участвующих в воспалении и ремоделировании матрикса. Джей Инвест Дерматол. 2006; 126:1071–1079. [PubMed] [Google Scholar]
77. Kang S, Cho S, Chung JH, et al. Воспаление и деградация внеклеточного матрикса, опосредованные активированными транскрипционными факторами, ядерным фактором kappaB и активатором белка-1, при воспалительных поражениях акне in vivo. Ам Джей Патол. 2005;166:1691–1699. [Бесплатная статья PMC] [PubMed] [Google Scholar]
78. Ito A, Sakiguchi T, Kitamura K, et al. Создание системы культивирования клеток сальных желез хомяка. Дерматология. 1998; 197: 238–244. [PubMed] [Google Scholar]
79. Iwata C, Akimoto N, Sato T, et al. Увеличение липогенеза с помощью 15-дезокси-дельта-12,14-простагландина J2 в сальных железах хомяка: идентификация опосредованной цитохромом Р-450 продукции 15-дезокси-дельта-12,14-простагландина J2. Джей Инвест Дерматол. 2005; 125:865–872. [PubMed] [Академия Google]
Джей Инвест Дерматол. 2005; 125:865–872. [PubMed] [Академия Google]
80. Zhang Q, Seltmann H, Zouboulis CC, et al. Активация рецептора фактора активации тромбоцитов в себоцитах SZ95 приводит к продукции воспалительных цитокинов и простагландина E2. Опыт Дерматол. 2006; 15: 769–774. [PubMed] [Google Scholar]
81. Neufang G, Furstenberger G, Heidt M, et al. Аномальная дифференцировка эпидермиса у трансгенных мышей, конститутивно экспрессирующих циклооксигеназу-2 в коже. Proc Natl Acad Sci USA. 2001; 98:7629–7634. [Бесплатная статья PMC] [PubMed] [Google Scholar]
82. Zhang Q, Seltmann H, Zouboulis CC, et al. Участие PPARgamma в продукции простагландина E(2), опосредованной окислительным стрессом, в клетках сальных желез человека SZ95. Джей Инвест Дерматол. 2006; 126:42–48. [PubMed] [Google Scholar]
83. Zouboulis CC, Seltmann H, Alestas T. Zileuton предотвращает активацию лейкотриенового пути и снижает липогенез сальных желез. Опыт Дерматол. 2009 [PubMed] [Google Scholar]
84. Ganceviciene R, Fimmel S, Glass E, et al. Псориазин и фолликулярная гиперкератинизация в комедонах акне. Дерматология. 2006; 213: 270–272. [PubMed] [Академия Google]
Ganceviciene R, Fimmel S, Glass E, et al. Псориазин и фолликулярная гиперкератинизация в комедонах акне. Дерматология. 2006; 213: 270–272. [PubMed] [Академия Google]
85. Zouboulis CC, Voorhees JJ, Orfanos CE, et al. Топическая полностью транс-ретиноевая кислота (RA) вызывает раннее, скоординированное увеличение уровней мРНК RA-индуцируемого кожно-специфического гена/псориазина и клеточного RA-связывающего белка II, что предшествует кожной эритеме. Арка Дерматол Рез. 1996; 288: 664–669. [PubMed] [Google Scholar]
86. Tavakkol A, Zouboulis CC, Duell EA, et al. Индуцируемый ретиноевой кислотой специфичный для кожи ген (RIS-1/псориазин): молекулярное клонирование и анализ экспрессии генов в коже человека in vivo и в культивируемых клетках кожи in vitro. Мол Биол Респ. 1994;20:75–83. [PubMed] [Google Scholar]
87. Kim J, Ochoa MT, Krutzik SR, et al. Активация toll-подобного рецептора 2 при акне запускает воспалительные цитокиновые ответы. Дж Иммунол. 2002; 169:1535–1541.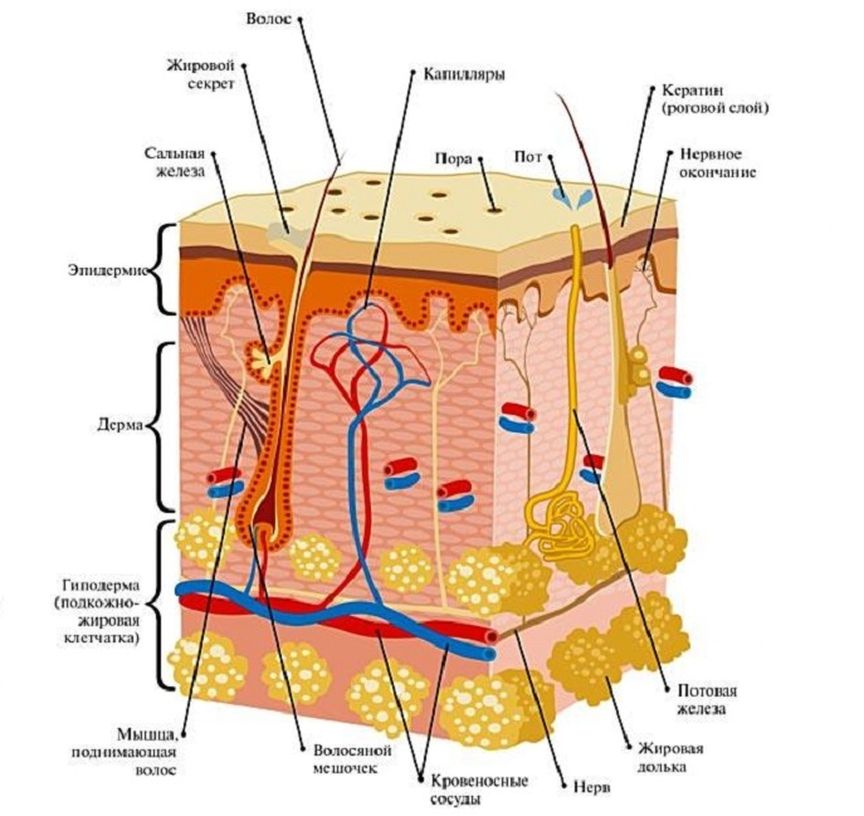 [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
88. Ким Дж. Обзор врожденного иммунного ответа при обыкновенных угрях: активация Toll-подобного рецептора 2 при акне запускает воспалительные цитокиновые ответы. Дерматология. 2005; 211:193–198. [PubMed] [Google Scholar]
89. Nagy I, Pivarcsi A, Kis K, et al. Propionibacterium acnes и липополисахарид индуцируют экспрессию противомикробных пептидов и провоспалительных цитокинов/хемокинов в себоцитах человека. микробы заражают. 2006; 8: 2195–2205. [PubMed] [Google Scholar]
90. Koreck A, Pivarcsi A, Dobozy A, et al. Роль врожденного иммунитета в патогенезе акне. Дерматология. 2003; 206: 96–105. [PubMed] [Google Scholar]
91. Georgel P, Crozat K, Lauth X, et al. Липидный эффекторный путь, чувствительный к toll-подобному рецептору 2, защищает млекопитающих от кожных инфекций, вызванных грамположительными бактериями. Заразить иммун. 2005; 73:4512–4521. [Бесплатная статья PMC] [PubMed] [Google Scholar]
92. Oeff MK, Seltmann H, Hiroi N, et al. Дифференциальная регуляция путей Toll-подобных рецепторов и CD14 ретиноидами и кортикостероидами в себоцитах человека. Дерматология. 2006; 213:266. [PubMed] [Google Scholar]
Oeff MK, Seltmann H, Hiroi N, et al. Дифференциальная регуляция путей Toll-подобных рецепторов и CD14 ретиноидами и кортикостероидами в себоцитах человека. Дерматология. 2006; 213:266. [PubMed] [Google Scholar]
93. Chronnell CM, Ghali LR, Ali RS, et al. Экспрессия бета-дефенсинов-1 и -2 человека в сально-волосяных единицах человека: активация в очагах обыкновенных угрей. Джей Инвест Дерматол. 2001; 117:1120–1125. [PubMed] [Google Scholar]
94. Lee DY, Yamasaki K, Rudsil J, et al. Себоциты экспрессируют функциональные кателицидиновые антимикробные пептиды и могут действовать, чтобы убить Пропионибактерии акне . Джей Инвест Дерматол. 2008; 128: 1863–1866. [Бесплатная статья PMC] [PubMed] [Google Scholar]
95. Graham GM, Farrar MD, Cruse-Sawyer JE, et al. Продукция провоспалительных цитокинов кератиноцитами человека, стимулированная Propionibacterium acnes и P. acnes GroEL. Бр Дж Дерматол. 2004; 150:421–428. [PubMed] [Google Scholar]
96. McDowell A, Valanne S, Ramage G, et al. Propionibacterium acnes типов I и II представляют собой филогенетически различные группы. Дж. Клин Микробиол. 2005; 43: 326–334. [Бесплатная статья PMC] [PubMed] [Google Scholar]
McDowell A, Valanne S, Ramage G, et al. Propionibacterium acnes типов I и II представляют собой филогенетически различные группы. Дж. Клин Микробиол. 2005; 43: 326–334. [Бесплатная статья PMC] [PubMed] [Google Scholar]
97. Harrison WJ, Bull JJ, Seltmann H, et al. Экспрессия липогенных факторов галектина-12, резистина, SREBP-1 и SCD в сальных железах человека и культивируемых себоцитах. Джей Инвест Дерматол. 2007; 127:1309–1317. [PubMed] [Google Scholar]
98. Nakatsuji T, Kao MC, Fang JY, et al. Антимикробное свойство лауриновой кислоты в отношении Propionibacterium acnes : ее терапевтический потенциал при воспалительных вульгарных угрях. Джей Инвест Дерматол. 2009;129:2480–2488. [Бесплатная статья PMC] [PubMed] [Google Scholar]
99. Nakatsuji T, Kao MC, Zhang L, et al. Свободные от кожного сала жирные кислоты усиливают врожденную иммунную защиту себоцитов человека путем усиления экспрессии бета-дефенсина-2. Джей Инвест Дерматол. 2009 [бесплатная статья PMC] [PubMed] [Google Scholar]
100. Nagy I, Pivarcsi A, Koreck A, et al. Отдельные штаммы Propionibacterium acnes индуцируют селективную экспрессию человеческого бетадефензина-2 и интерлейкина-8 в кератиноцитах человека через толл-подобные рецепторы. Джей Инвест Дерматол. 2005;124:931–938. [PubMed] [Google Scholar]
Nagy I, Pivarcsi A, Koreck A, et al. Отдельные штаммы Propionibacterium acnes индуцируют селективную экспрессию человеческого бетадефензина-2 и интерлейкина-8 в кератиноцитах человека через толл-подобные рецепторы. Джей Инвест Дерматол. 2005;124:931–938. [PubMed] [Google Scholar]
101. Schaller M, Loewenstein M, Borelli C, et al. Индукция хемоаттрактивного провоспалительного цитокинового ответа после стимуляции кератиноцитов Propionibacterium acnes и копропорфирином III. Бр Дж Дерматол. 2005; 153:66–71. [PubMed] [Google Scholar]
Физиология, сальные железы — StatPearls
Эзра Гувер; Сана Аслам; Картик Кришнамурти.
Информация об авторе
Последнее обновление: 10 октября 2022 г.
Введение
Сальная железа является неотъемлемой частью структуры и функции кожи, обеспечивая 90% ее поверхностных липидов. В то время как большая часть внимания, связанного с сальной железой, связана с ее центральной ролью в вульгарных угрях, было выявлено несколько новых функций, которые подчеркивают сложную роль этой универсальной клеточной единицы в гомеостазе кожи. Сальная железа особенная по крайней мере в двух отношениях. Во-первых, продукт этой железы синтезируется с помощью голокриновой секреции — уникального метода, характеризующегося целенаправленным саморазрушением ее первичной клеточной единицы — себоцита. Во-вторых, несмотря на то, что они имеют эпителиальное происхождение и обладают многочисленными гормональными рецепторами, себоциты участвуют в синтезе и метаболизме липидов, что обычно выполняют адипоциты. Таким образом, сальную железу можно рассматривать как гормональную мишень, так и эндокринный орган.[1][2][3]
Сальная железа особенная по крайней мере в двух отношениях. Во-первых, продукт этой железы синтезируется с помощью голокриновой секреции — уникального метода, характеризующегося целенаправленным саморазрушением ее первичной клеточной единицы — себоцита. Во-вторых, несмотря на то, что они имеют эпителиальное происхождение и обладают многочисленными гормональными рецепторами, себоциты участвуют в синтезе и метаболизме липидов, что обычно выполняют адипоциты. Таким образом, сальную железу можно рассматривать как гормональную мишень, так и эндокринный орган.[1][2][3]
Производство кожного сала является наиболее важной функцией сальных желез у человека. Уникальной особенностью сальной железы является производство сквалена и некоторых жирных кислот. Производство кожного сала имеет решающее значение для поддержания гомеостаза кожи, смазки и физиологической защиты от внешних и инфекционных воздействий.
Клеточный
Сальные железы можно идентифицировать по их «пенистому» виду при микроскопии. Клетки кажутся круглыми и пустыми, потому что их большое количество липидов вымывается в процессе окрашивания. Липиды можно визуализировать с помощью красителя Нила красного, липофильного красителя. Относительно недифференцированные себоциты располагаются вдоль наружных слоев железы, постепенно становясь более дифференцированными и наполненными липидными продуктами по направлению к центру. В центре зрелые себоциты подвергаются апоптозу, деградируют и образуют зону некроза, в конечном итоге высвобождая свое содержимое, которое объединяется с образованием кожного сала. Этот процесс синтеза и выделения липидов занимает в общей сложности около одной недели.
Клетки кажутся круглыми и пустыми, потому что их большое количество липидов вымывается в процессе окрашивания. Липиды можно визуализировать с помощью красителя Нила красного, липофильного красителя. Относительно недифференцированные себоциты располагаются вдоль наружных слоев железы, постепенно становясь более дифференцированными и наполненными липидными продуктами по направлению к центру. В центре зрелые себоциты подвергаются апоптозу, деградируют и образуют зону некроза, в конечном итоге высвобождая свое содержимое, которое объединяется с образованием кожного сала. Этот процесс синтеза и выделения липидов занимает в общей сложности около одной недели.
Развитие
Сальные железы расположены в средней части дермы и почти всегда развиваются рядом с волосяным фолликулом, выходное отверстие которого впадает в фолликулярный канал. Эта ассоциация известна как сально-волосяная единица. Небольшое количество сальных желез, известных как мейбомиевы железы, открываются непосредственно на коже в эпителии век и помогают усилить смазывающие свойства слез.
Эмбриологическое развитие сальной железы заключается в процессе врастания эктодермальных клеток в мезодерму. К 13-15 неделям внутриутробного развития можно отчетливо визуализировать сальные железы, дифференцирующиеся в цефалокаудальной последовательности в сочетании с волосяным фолликулом. В 17 недель в центре железы становятся видны липидные капли. Развивающийся общий выводной проток, который будет служить фокальной точкой прикрепления ацинусов сальных желез, начинается как твердая тяжеобразная структура. Заполненные кожным салом клетки, составляющие пуповину, в конечном итоге разрываются и образуют канал, который становится первым сально-волосяным каналом. Отверстие протока сальной железы в волосяной фолликул является важной анатомической границей; между этим отверстием и мышцей, поднимающей волосы, находится область выпуклости волосяного фолликула, жизненно важный источник местных стволовых клеток. Интересно, что кожное сало, очевидно, является первым железистым продуктом, вырабатываемым организмом.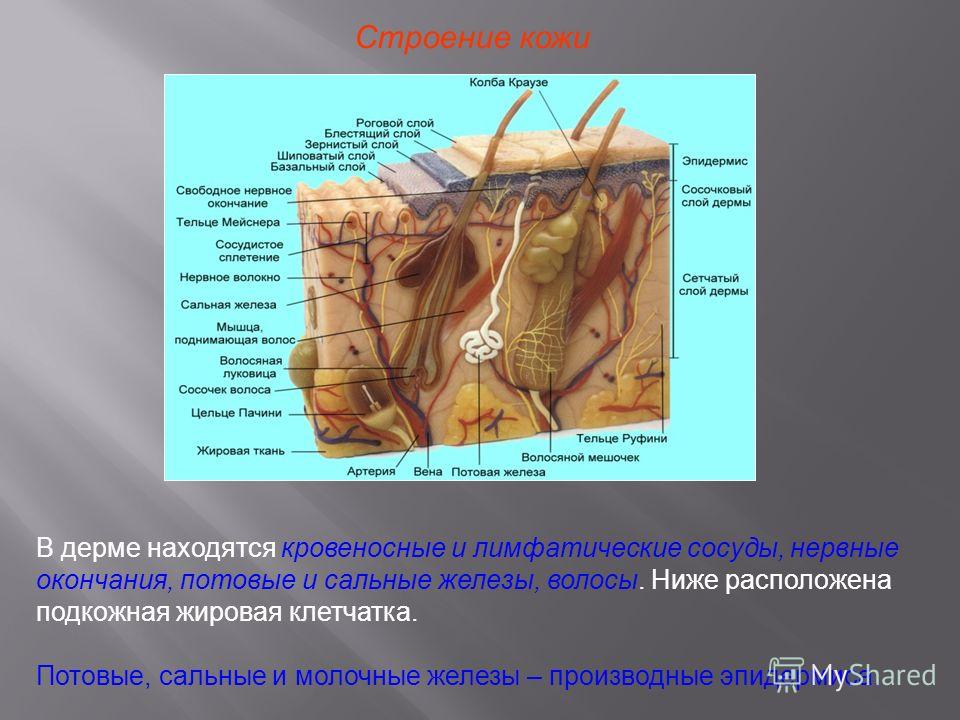 Активность сальных желез увеличивается через несколько часов после рождения и достигает пика в течение первой недели жизни, снижаясь до следующего пика во время адренархе (около девяти лет) и примерно до 18 лет. Примерное количество сальных желез обычно остается постоянным на протяжении всей жизни, но их размер имеет тенденцию к увеличению с возрастом, особенно в подростковом возрасте.[4]
Активность сальных желез увеличивается через несколько часов после рождения и достигает пика в течение первой недели жизни, снижаясь до следующего пика во время адренархе (около девяти лет) и примерно до 18 лет. Примерное количество сальных желез обычно остается постоянным на протяжении всей жизни, но их размер имеет тенденцию к увеличению с возрастом, особенно в подростковом возрасте.[4]
Функция
Сальные железы производят подавляющее большинство липидов на поверхности кожи через свой основной продукт, кожное сало, которое помогает удерживать влагу и предотвращает высыхание кожи. Поскольку сальные железы впадают в волосяной канал, кожное сало в основном выходит на поверхность кожи за счет впитывания волосяного стержня. Помимо клеточного дебриса и липидов кожное сало также содержит противомикробные вещества, свободные жирные кислоты и матриксные металлопротеиназы. Эти элементы в сочетании с образованием кожной липидной пленки помогают защитить кожу от внешних воздействий. [6][7]
[6][7]
Сальные железы также являются важным местом обработки и модуляции андрогенов. Все ферменты, необходимые для преобразования холестерина в стероиды или предшественники надпочечников, такие как дегидроэпиандростерон, находятся в коже. Сальные железы также могут инактивировать андрогены с помощью гидроксистероиддегидрогеназы, фермента, присутствующего уже на 16-й неделе жизни плода. Изоформа 5-альфа-редуктазы типа 1, которая служит для превращения тестостерона в его наиболее активную форму, также в изобилии вырабатывается в сальных железах, особенно в сальных железах, расположенных на лице и коже головы.
Сальные железы также находятся под гормональным контролем. Андрогены регулируют функцию сальных желез путем связывания с ядерными андрогенными рецепторами (АР). AR присутствуют во многих компонентах кожи, особенно в сальных железах, где андрогены стимулируют пролиферацию клеток и липогенез.
Кортикотропин-рилизинг-гормон (CRH) стимулирует локальные рецепторы клеток кожи с помощью паракринных методов, что приводит к повышению уровня проопиомеланокортина (POMC) и снижению синтеза IL-8 в себоцитах, а также вызывает выработку кортизола. Вместе эти эффекты обладают мощным противовоспалительным эффектом, который противодействует нормальному каскаду сигналов стресса и помогает ограничить чрезмерное повреждение тканей.
Вместе эти эффекты обладают мощным противовоспалительным эффектом, который противодействует нормальному каскаду сигналов стресса и помогает ограничить чрезмерное повреждение тканей.
Клиническое значение
Наиболее часто обсуждаемой патологией сальных желез являются вульгарные угри. По некоторым оценкам, до 80% людей в какой-то момент своей жизни сталкиваются с акне, а у 20% из них проявляются тяжелые формы, включающие болезненные кисты, образование свищевых ходов и постоянные рубцы. Патогенез акне сложен, при этом важную роль играют сальные железы. В период полового созревания высокий уровень выработки андрогенов стимулирует сальные железы к увеличению выработки кожного сала. Эта активность приводит к образованию кожных пробок, что в сочетании с другими факторами приводит к характерным открытым (черные точки) и закрытым (белые точки) комедонам акне. Многие люди имеют форму акне при рождении. Acne neonatorum, которые проявляются в течение первых четырех недель жизни, встречаются у 20% новорожденных.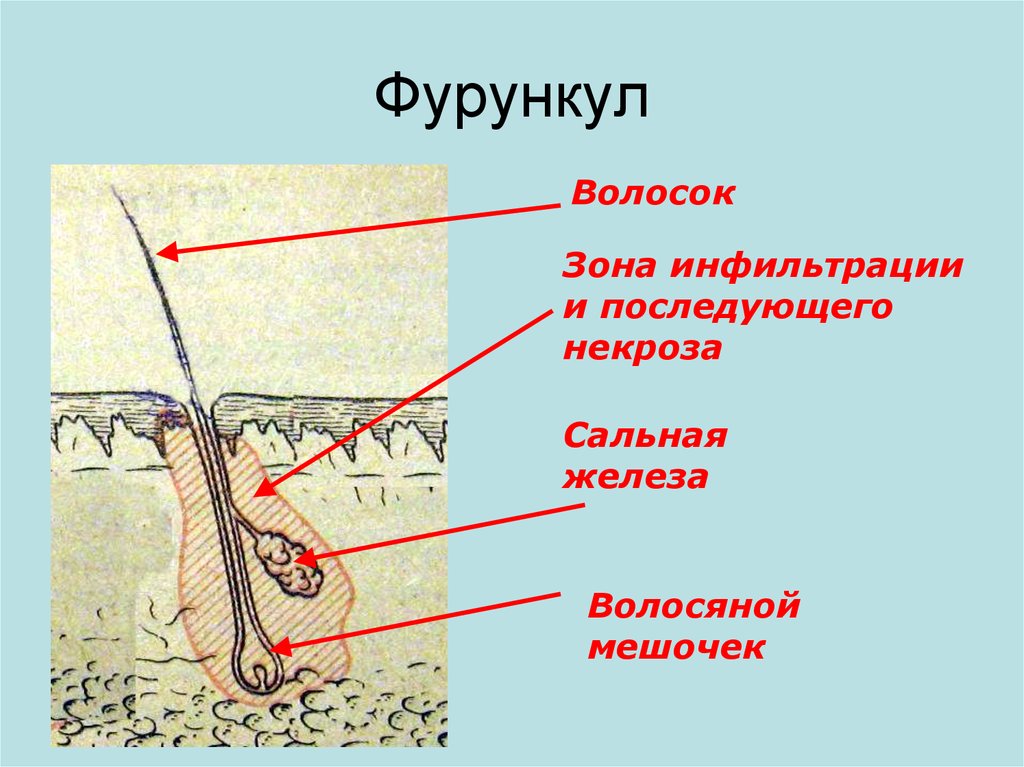 Кроме того, детские прыщи тесно связаны с развитием стойких прыщей в более позднем возрасте.]
Кроме того, детские прыщи тесно связаны с развитием стойких прыщей в более позднем возрасте.]
Сальная железа обычно приобретает увеличенный вид с возрастом пациентов. Это доброкачественное состояние известно как сальная гиперплазия. Хотя эти небольшие поражения вызывают чисто косметическое раздражение, они могут выглядеть похожими на базальноклеточную карциному и побуждать неопытного практикующего врача к ненужной биопсии. Однако сальные железы могут иногда давать опухоли, известные как сальные аденомы. Синдром Мьюира-Торре, редкое аутосомно-доминантное заболевание, характеризуется новообразованиями сальных желез, а также злокачественными новообразованиями внутренних органов. Согласно некоторым исследованиям, высокий потенциал метастазирования и летального исхода при этом синдроме (до 25%) обусловливает необходимость хирургического удаления этих образований с широкими полями для снижения риска рецидива.[10][11]
Интересно, что сальные железы, по-видимому, также связаны с андрогенетической алопецией или облысением, генетическим заболеванием, сопровождающимся постепенным уменьшением размера, качества и количества волос на голове. Гистологическое исследование пораженных участков демонстрирует заметное увеличение размера ассоциированной сальной железы, что позволяет предположить, что чрезмерный рост железы и относительное сохранение фолликулярных стволовых клеток могут быть важными факторами в этиологии этого состояния.
Гистологическое исследование пораженных участков демонстрирует заметное увеличение размера ассоциированной сальной железы, что позволяет предположить, что чрезмерный рост железы и относительное сохранение фолликулярных стволовых клеток могут быть важными факторами в этиологии этого состояния.
Контрольные вопросы
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Рисунок
Общий кожный покров, срез кожи, показывающий эпидермис и дерму; волос в фолликуле; мышца, выпрямляющая волосы; сальные железы. Предоставлено Gray’s Anatomy Plates
Рисунок
Сальная аденома. Предоставлено Сарой Феррер-Брукер, DO.
Рисунок
Сальные железы, H/E 10x. Предоставлено Фабиолой Фарчи, доктором медицины
Рисунок
Себоциты, клетки сальных желез. Х/Э 40x. Предоставлено Fabiola Farci, MD
Рисунок
Поперечное сечение слоев кожи.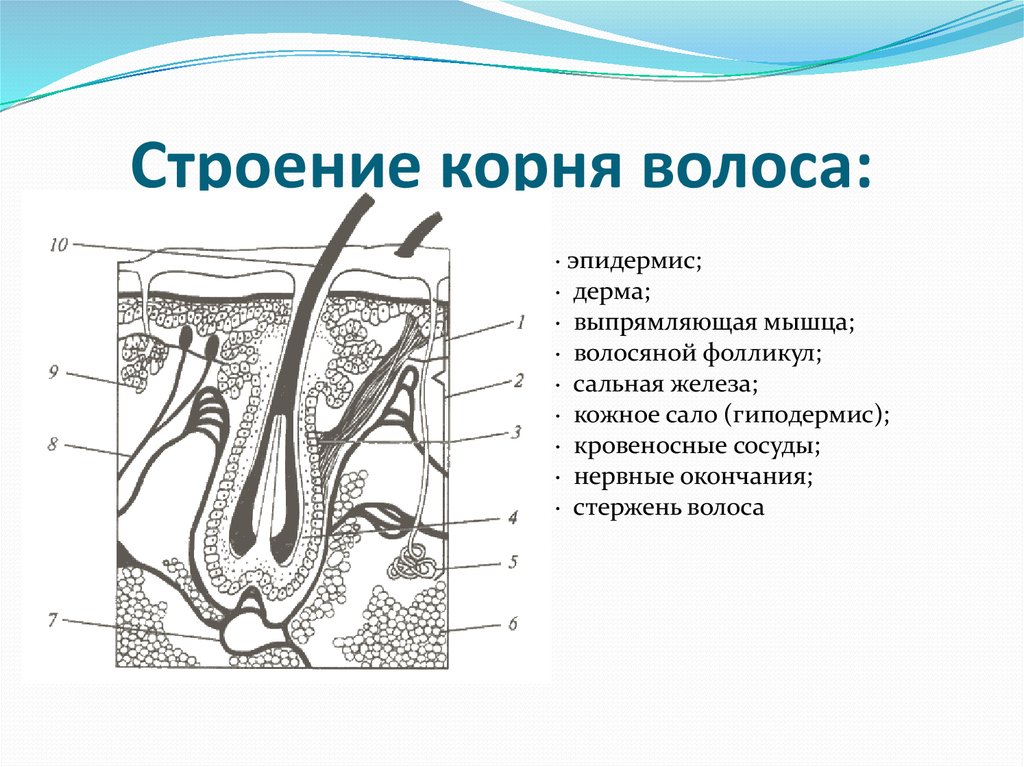 Волосяные фолликулы, корни и стержни волос, потовые железы, поры, эпидермис, дерма, гиподерма. Сосочковый и ретикулярный слой. Эккриновые потовые железы. Мышцы, выпрямляющие волосы, сальные железы. Предоставлено Chelsea (подробнее…)
Волосяные фолликулы, корни и стержни волос, потовые железы, поры, эпидермис, дерма, гиподерма. Сосочковый и ретикулярный слой. Эккриновые потовые железы. Мышцы, выпрямляющие волосы, сальные железы. Предоставлено Chelsea (подробнее…)
Ссылки
- 1.
Агарвал С., Кришнамурти К. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 8 мая 2022 г. Гистология, кожа. [В паблике: 30726010]
- 2.
Паниагуа Гонсалес Л.М., Чен Дж.А., Коэн П.Р. Эктопические сальные железы в матрице волосяного фолликула: отчеты о случаях заболевания и обзор литературы по этой эмбриогенной аномалии. Куреус. 2018 17 ноября; 10 (11): e3605. [Бесплатная статья PMC: PMC6338400] [PubMed: 30680266]
- 3.
Фултон Э.Х., Кейли Дж.Р., Гарднер Дж.М. Опухоли придатков кожи простым языком: практический подход для общего хирургического патологоанатома. Arch Pathol Lab Med. 2019 июль; 143 (7): 832-851. [В паблике: 30638401]
- 4.

Зубулис CC. [Сальная железа]. Hautarzt. 2010 июнь; 61(6):467-8, 4704, 476-7. [PubMed: 20512305]
- 5.
Пикардо М., Мастрофранческо А., Биро Т. Сальные железы — основной игрок в гомеостазе кожи. Опыт Дерматол. 2015 июль; 24 (7): 485-6. [PubMed: 25865503]
- 6.
Weir CB, St.Hilaire NJ. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 27 октября 2021 г. Киста эпидермального включения. [В паблике: 30335343]
- 7.
Zaballos P, Gómez-Martín I, Martin JM, Bañuls J. Дерматоскопия опухолей придатков. Дерматол клин. 2018 окт; 36 (4): 397-412. [PubMed: 30201149]
- 8.
Сюй Х., Ли Х. Акне, микробиом кожи и лечение антибиотиками. Am J Clin Дерматол. 20 июня 2019 г.; 20(3):335-344. [Бесплатная статья PMC: PMC6534434] [PubMed: 30632097]
- 9.
Schneider MR, Zouboulis CC. Первичные себоциты и клеточные линии сальных желез для изучения сального липогенеза и заболеваний сальных желез.