ФИО или Ф.И.О. — Говорим и пишем правильно — ЖЖ
?
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Top of Page | Разработано LiveJournal.com |
ФИО или Ф, И и О?
← →
Некто ©
(2006-04-01 09:39) [0]
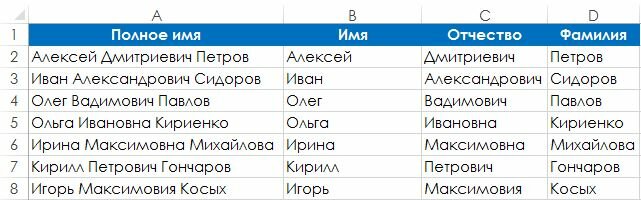
Чем руководствоваться при проектировании таблиц БД, где будут встречаться эти атрибуты? Хранить в одном поле или по разным?
← →
sniknik ©
(2006-04-01 09:47) [1]
> Чем руководствоваться .
сложить легко, разобрать (правильно) практически невозможно.
← →
Бугага ©
(2006-04-01 14:20) [2]
> Некто © (01.04.06 09:39)
Я обычно выбираю вариант ФИО, если нет необходимости выводить отдельно Ф И О (как было сказано в [1]), так как пользователям обычно удобнее вводить все в одну строку, не дергая при этом TAB
← →
Проходил мимо
(2006-04-02 20:20) [3]
> Чем руководствоваться
Предметной областью руководствоваться.
Иногда вообще приходиться так извращаться: вводить справочник имен и отчеств и делать внешние ключи на них. В клиентской части делаешь быстрый поиск по нему с проверкой по первым набранным буквам- получаешь «умное» окно редактирования.
← →
Megabyte ©
(2006-04-03 14:10) [4]
> sniknik © (01.04.06 09:47) [1]
> > Чем руководствоваться …
> сложить легко, разобрать (правильно) практически невозможно.
Почему разобрать невозможно? Там же обычно все три поля разделены пробелами и все. Да пофигу, чем разделены. Индивидуальные извращения, когда все написано в одну строку, рассматривать не будем…
← →
Sergey13 ©
(2006-04-03 14:12) [5]
2[4] Megabyte © (03.04.06 14:10)
> Почему разобрать невозможно?
Ну разбери. Остап Сулейман Берта Мария Бендер-бей. 😎
← →
Megabyte ©
(2006-04-03 14:14) [6]
Хм. %) Ну обычно там всего 3 слова. :Р
%) Ну обычно там всего 3 слова. :Р
Думаю, если делать для определенной группы иностранцев, то там тоже есть свои правила для ФИО. Сложно, не спорю, но не невозможно. 🙂
← →
MsGuns ©
(2006-04-03 14:28) [7]
ФИО — это три разные СУЩНОСТИ, хотя бы с точки зрения поисков и фильтров. Хранить предпочтительнее в отдельных полях, а в списках (гридах) отображать — в одном (например, как Fam+» «+Nam+» «+Nam1).
Редактировать давать либо вместе, либо в отдельных контролах (с возможностью выбора имен и отчеств из справочников или без)
← →
Sergey13 ©
(2006-04-03 14:33) [8]
Опа! Ганз появился. Я аж соскучился. 😎
← →
sniknik ©
(2006-04-03 14:46) [9]
> Почему разобрать невозможно?
человек пишет. .. а это самая глючная часть системы. даже если задаш жесткие правила по которым писать все одно сделает по своему, если это возможно.
.. а это самая глючная часть системы. даже если задаш жесткие правила по которым писать все одно сделает по своему, если это возможно.
Иванова Марья Ивановна
Марья Ивановна Иванова
Петровичь
Никанор, Олеговичь
…
будеш после после «возникать» почему не в том порядке, или только имя? будут смотреть добрыми, глупыми глазами и отвечать «а чего, меня все и так тут знают, Петрович я и есть Петрович», и хоть кипятком писай, обьясняя что для системы важна фамилия, причем первой… таких сложных вещей они не понимают.
это еще не считая Sergey13 © (03.04.06 14:12) [5] ;о)
> когда все написано в одну строку, рассматривать не будем…
почему не будем? «защита» именно против этого.
← →
Sergey Masloff
(2006-04-03 20:34) [10]
MsGuns © (03.04.06 14:28) [7]
ФИО — это три разные СУЩНОСТИ, хотя бы с точки зрения поисков и фильтров
1) И часто приходится по отчествам фильтровать?
2) А что делать с теми у кого там не три слова и хрен знает что там за отчества
Вобщем я бы рекомендовал 2 поля:
1) Полное — Иванов Александр Петрович
2) Поисковое — формируется по дефолту из полного в UPPERCASE первое слово целиком остальные по букве с точкой ИВАНОВ А. П. (но с возможностью ввести руками иное)
П. (но с возможностью ввести руками иное)
Проверено
← →
Ильш ©
(2006-04-04 06:09) [11]
а не проще три поля Ф И О ???
а сложить их и сделать UPPERCASE или еще что-то можно уже запросом
пользователям удобнее вводить не дергая ТАВ ???
ну уж ваще 🙁 пусть учатся!
не надо советовать человеку ересь, друзья
отдельно три поля и фсе 🙂
← →
K_VAL
(2006-04-04 08:37) [12]
По опыту знаю , что лучше сделать 3 поля — Фам , Им , От .
Поиск лучше органивать : 1 — фамилия
2 — имя
3 — отчество
и данные в порядке :
ИВАНОВ …
ПЕТРОВ …
СИДОРОВ …
Нет никаких заморочек , данные вводятся быстро , можно сделать переход по клавише <ENTER> , так оператору привычнее и удобннее , она под рукой , можно сделать ограничение по кол-ву символов , возможны варианты .
← →
de_ICER-T44
(2006-04-04 09:00) [13]
only
1 Фамилия С 120
2 Имя С 80
3 Отчество С 120
+ ввод из справочников, как указано выше….
по поводу фильтра пральна сказали — так фильтровать удобнее.
При необходимости фамилия — UpperCase, обеспечение быстрого поиска loPartialKey (дабы юзвери не заморачивались регистром букв).
По желанию — Grid отрисовывать на фамилию, имя, отчество одним цветом по бордеру…. будет ощущение цельности строки…
хмм.. что вообще тут сказать? поле деятельности — оушэн больший:)))
← →
MsGuns ©
(2006-04-04 10:08) [14]
>Sergey Masloff (03.04.06 20:34) [10]
В общем случае, конечно, надо держать произвольное кол-во полей с признаком — порядком (как, по слухам, в картотеке ФБР). Такая структура вместит в себя любые имена, включая восточные и латиноамериканские.
Такая структура вместит в себя любые имена, включая восточные и латиноамериканские.
Для славян вполне подходит система «три в одном», где многословными бывают только фамилии.
Не раз и не два приходилось проектировать «человеческие» базы, в т.ч. достаточно обширные. Система раздельного хранения трех частей себя полностью оправдала.
Отчества, как и имена, надо выделять хотя бы потому, что весьма целесообразно «собирать» из них виртуальный справочник, очень облегчающий и убыстряющий процедуру ввода информации.
← →
Megabyte ©
(2006-04-04 14:06) [15]
> > когда все написано в одну строку, рассматривать не будем.
> ..
> почему не будем? «защита» именно против этого.
Так можно маску ввода задать. %)
← →
sniknik ©
(2006-04-04 14:56) [16]
> Так можно маску ввода задать. %)
%)
покажи такую маску… на переменное количество символов и плюс на обязательное разделение имени с фамилией при слитном вводе.
pH обычных кислот и оснований
Расчетные значения pH обычных кислот и оснований для 1, 10 и 100 ммоль/л (действительно для стандартных условий при 25 , 1 атм; константы кислотности взяты отсюда):
| • кислоты: | , отсортированные по pH или формуле |
| • основания: | , отсортированные по pH или формуле |
| • органика: | органические кислоты и соли |
| • другие реакции: Бесплатное программное обеспечение (Пример) Демонстрация: онлайн-калькулятор pH |
pH кислот — Сортировка по pH
| Кислота | Имя | 1 мМ | 10 мМ | 100 мМ | |
|---|---|---|---|---|---|
| H 2 SeO 4 | селеновая кислота | 2,74 | 1,83 | 0,97 | |
| Н 2 SO 4 | серная кислота | 2,75 | 1,87 | 1. 01 01 | |
| Привет | йодистоводородная кислота | 3.01 | 2.04 | 1,08 | |
| HBr | бромистоводородная кислота | 3.01 | 2.04 | 1,08 | |
| HCl | соляная кислота | 3.01 | 2.04 | 1,08 | |
| HNO 3 | азотная кислота | 3.01 | 2.04 | 1,08 | |
| H 3 Заказ на покупку 4 | ортофосфорная кислота | 3,06 | 2,26 | 1,63 | |
| Н 3 АсО 4 | мышьяковая кислота | 3,08 | 2,31 | 1,70 | |
| H 2 SeO 3 | селенистая кислота | 3,15 | 2,47 | 1,90 | |
| H 2 CrO 4 | хромовая кислота | 3,03 | 2,33 | 2,06 | |
| h4цитрат | лимонная кислота, C 6 H 8 O 7 | 3,24 | 2,62 | 2,08 | |
| ВЧ | фтористоводородная кислота | 3,27 | 2,65 | 2. 12 12 | |
| HNO 2 | азотистая кислота | 3,28 | 2,67 | 2,13 | |
| Гидроцианат | изоциановая кислота, HOCN | 3,35 | 2,76 | 2,23 | |
| HFormate | муравьиная кислота, CH 2 O 2 (метановая кислота) | 3,47 | 2,91 | 2,38 | |
| Н 2 Се | селенид водорода | 3,49 | 2,93 | 2,41 | |
| H 2 MoO 4 | молибденовая кислота | 3,46 | 2,94 | 2,43 | |
| ГЛактат | молочная кислота, C 3 H 6 O 3 (молочная кислота) | 3,51 | 2,96 | 2,44 | |
| ХАцетат | уксусная кислота, C 2 H 4 O 2 (этановая кислота) | 3,91 | 3,39 | 2,88 | |
| H 2 CO 3 | угольная кислота | 4,68 | 4.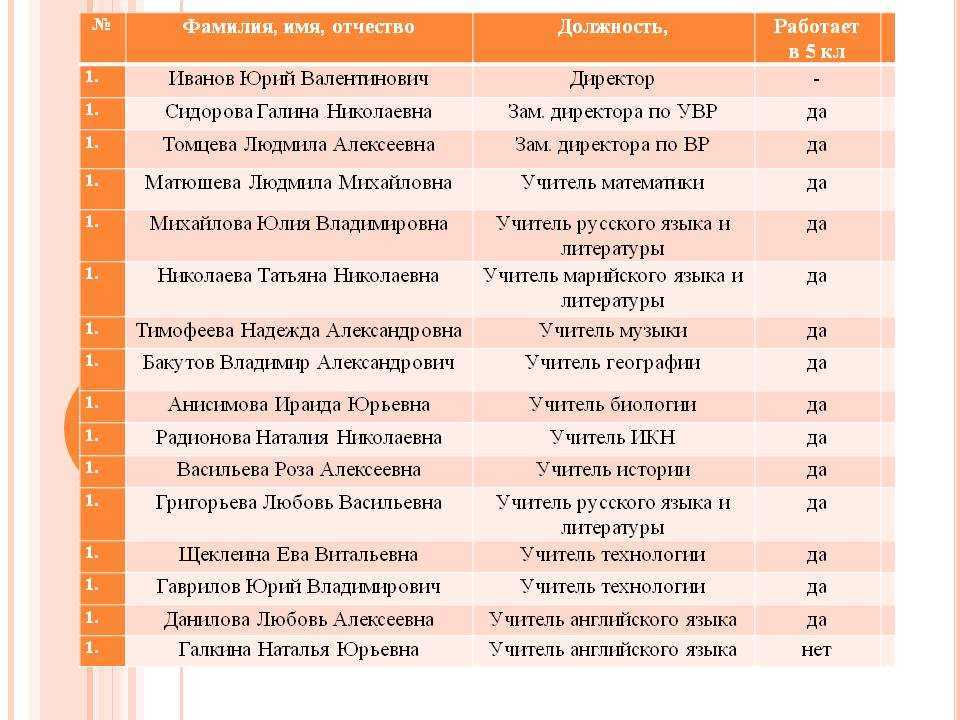 18 18 | 3,68 | |
| В 2 Ю | сероводород | 4,97 | 4,47 | 3,97 | |
| Н 3 АсО 3 | мышьяковистая кислота | 6.07 | 5,58 | 5,09 | |
| Гидроцианид | синильная кислота, HCN | 6.11 | 5,62 | 5.12 | |
| Н 3 БО 3 | борная кислота | 6.12 | 5,62 | 5.12 | |
| H 4 SiO 4 | кремниевая кислота | 6,40 | 5,91 | 5,42 | |
| H 4 SiO 4 | кремниевая кислота (с SiO 2 (a) осаждением) | 6,40 | 6,26 | 6,26 |
рН кислот — отсортировано по формуле
| Кислота | Имя | 1 мМ | 10 мМ | 100 мМ | |
|---|---|---|---|---|---|
| H 2 CO 3 | угольная кислота | 4,68 | 4.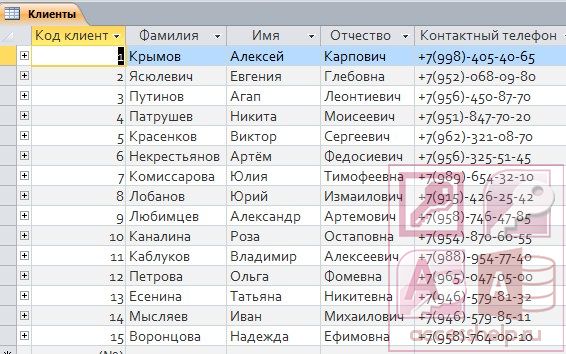 18 18 | 3,68 | |
| H 2 CrO 4 | хромовая кислота | 3,03 | 2,33 | 2,06 | |
| H 2 MoO 4 | молибденовая кислота | 3,46 | 2,94 | 2,43 | |
| В 2 Ю | сероводород | 4,97 | 4,47 | 3,97 | |
| Н 2 Се | селенид водорода | 3,49 | 2,93 | 2,41 | |
| H 2 SeO 3 | селенистая кислота | 3,15 | 2,47 | 1,90 | |
| H 2 SeO 4 | селеновая кислота | 2,74 | 1,83 | 0,97 | |
| Н 2 SO 4 | серная кислота | 2,75 | 1,87 | 1. 01 01 | |
| Н 3 АсО 3 | мышьяковистая кислота | 6.07 | 5,58 | 5,09 | |
| Н 3 АсО 4 | мышьяковая кислота | 3,08 | 2,31 | 1,70 | |
| Н 3 БО 3 | борная кислота | 6.12 | 5,62 | 5.12 | |
| H 3 Цитрат | лимонная кислота, C 6 H 8 O 7 | 3,24 | 2,62 | 2.08 | |
| Н 3 Заказ на покупку 4 | ортофосфорная кислота | 3,06 | 2,26 | 1,63 | |
| H 4 SiO 4 | кремниевая кислота | 6,40 | 5,91 | 5,42 | |
| H 4 SiO 4 | кремниевая кислота (с осаждением SiO2(a)) | 6,40 | 6,26 | 6,26 | |
| ХАцетат | уксусная кислота, C 2 H 4 O 2 (этановая кислота) | 3,91 | 3,39 | 2,88 | |
| HBr | бромистоводородная кислота | 3. 01 01 | 2.04 | 1,08 | |
| HCl | соляная кислота | 3.01 | 2.04 | 1,08 | |
| Гидроцианат | изоциановая кислота, HOCN | 3,35 | 2,76 | 2,23 | |
| Гидроцианид | синильная кислота, HCN | 6.11 | 5,62 | 5.12 | |
| ВЧ | фтористоводородная кислота | 3,27 | 2,65 | 2.12 | |
| HFormate | муравьиная кислота, CH 2 O 2 (метановая кислота) | 3,47 | 2,91 | 2,38 | |
| Привет | йодистоводородная кислота | 3. 01 01 | 2.04 | 1,08 | |
| ГЛактат | молочная кислота, C 3 H 6 O 3 (молочная кислота) | 3,51 | 2,96 | 2,44 | |
| HNO 2 | азотистая кислота | 3,28 | 2,67 | 2,13 | |
| HNO 3 | азотная кислота | 3.01 | 2.04 | 1,08 |
pH оснований — Сортировка по pH
Учитывается ограниченная растворимость гидроксидов (как указано в сносках в последней колонке).
| Основание | Имя | 1 мМ | 10 мМ | 100 мМ | |
|---|---|---|---|---|---|
| Ва(ОН) 2 | бария гидроксид | 11.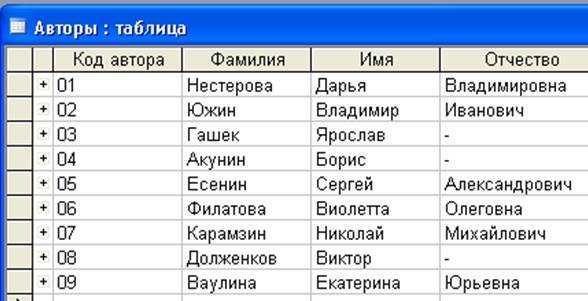 27 27 | 12.22 | 13.08 | 1 |
| Sr(ОН) 2 | гидроксид стронция | 11.27 | 12.22 | 13.09 | |
| NaOH | гидроксид натрия | 10,98 | 11,95 | 12,88 | |
| КОН | гидроксид калия (калий едкий) | 10,98 | 11,95 | 12,88 | |
| Na 2 SiO 3 | метасиликат натрия | 11.00 | 11,91 | 12,62 | |
| Са(ОН)2 | гидроксид кальция (известь, CaO:H 2 O) | 11.27 | 12.20 | 12,46 | 2 |
| Нет данных 3 Заказ на поставку 4 | тринатрийфосфат | 10,95 | 11,71 | 12. 12 12 | |
| К 2 CO 3 | карбонат калия | 10,52 | 11.00 | 11.36 | |
| Na 2 CO 3 | карбонат натрия (кальцинированная сода) | 10,52 | 10,97 | 11.26 | |
| НХ 4 ОХ | гидроксид аммония (NH 3 :Н 2 О) | 10.09 | 10,61 | 11.12 | |
| Мг(ОН) 2 | гидроксид магния (MgO:H 2 O) | 10.40 | 10.40 | 10.40 | 3 |
| CaCO 3 | карбонат кальция (кальцит) | 9,91 | 9,91 | 9,91 | 4 |
| Fe(OH) 2 | гидроксид железа(II) (гидроксид железа) | 9,45 | 9,45 | 9,45 | 5 |
| Cd(ОН) 2 | кадмия гидроксид | 9,36 | 9,36 | 9,36 | 6 |
| Нет 2 В 4 О 7 | борат натрия (бура) | 9.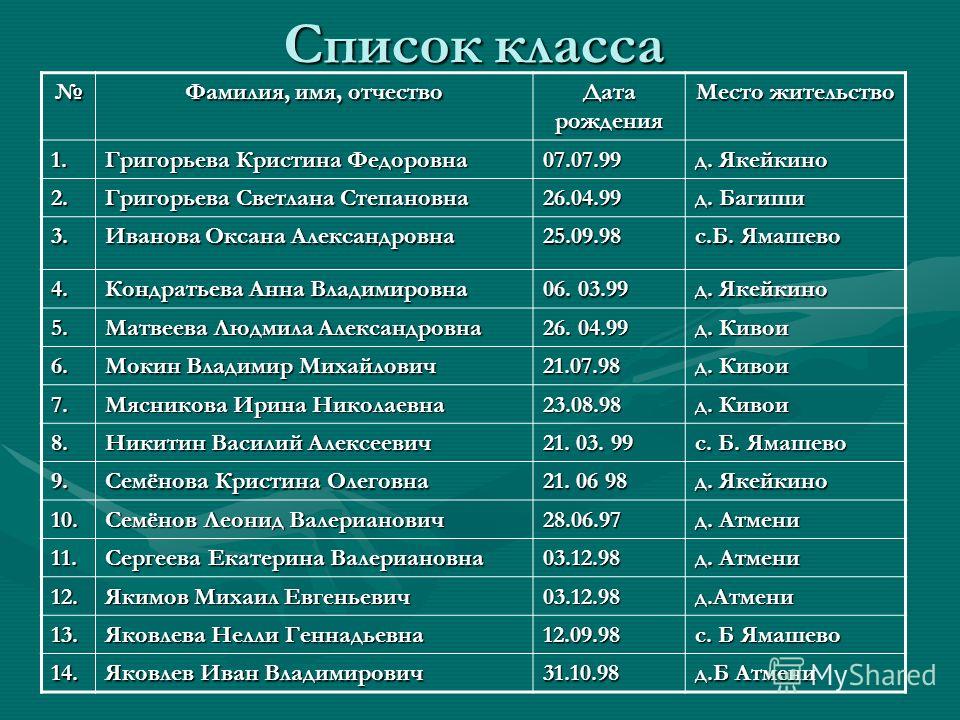 21 21 | 9.17 | 9.05 | |
| Со(ОН) 2 | гидроксид кобальта(II) | 9,15 | 9,15 | 9,15 | 7 |
| Zn(OH) 2 | гидроксид цинка | 8,88 | 8,88 | 8,88 | 8 |
| Ni(ОН) 2 | никеля(II) гидроксид | 8,37 | 8,37 | 8,37 | 9 |
| KАцетат | ацетат калия (CH 3 COOK) | 7,87 | 8,33 | 8,75 | |
| Ацетат натрия | ацетат натрия (CH 3 COONa) | 7,87 | 8,33 | 8,75 | |
| КНСО 3 | гидрокарбонат калия | 8,27 | 8,25 | 8. 13 13 | |
| NaHCO 3 | гидрокарбонат натрия | 8,27 | 8,22 | 8.02 | |
| Бе(ОН) 2 | гидроксид бериллия | 7,90 | 7,90 | 7,90 | 10 |
| Cu(OH) 2 | гидроксид меди(II) | 7,69 | 7,69 | 7,69 | 11 |
| Pb(OH) 2 | гидроксид свинца(II) | 7,54 | 7,54 | 7,54 | 12 |
| Cr(OH) 3 | хрома(III)гидроксид | 7.04 | 7.04 | 7.04 | 13 |
| Рт(ОН) 2 | ртути(II) гидроксид | 7. 03 03 | 7.03 | 7.03 | 14 |
pH оснований — отсортировано по формуле
| Основание | Имя | 1 мМ | 10 мМ | 100 мМ | |
|---|---|---|---|---|---|
| Ва(ОН) 2 | бария гидроксид | 11.27 | 12.22 | 13.08 | 1 |
| Бе(ОН) 2 | гидроксид бериллия | 7,90 | 7,90 | 7,90 | 10 |
| Са(ОН) 2 | гидроксид кальция (известь, CaO:H 2 O) | 11.27 | 12.20 | 12,46 | 2 |
| CaCO 3 | карбонат кальция (кальцит) | 9,91 | 9,91 | 9,91 | 4 |
| Cd(ОН) 2 | кадмия гидроксид | 9,36 | 9,36 | 9,36 | 6 |
| Со(ОН) 2 | гидроксид кобальта(II) | 9,15 | 9,15 | 9,15 | 7 |
| Cr(OH) 3 | хрома(III) гидроксид | 7. 04 04 | 7.04 | 7.04 | 13 |
| Cu(OH) 2 | гидроксид меди(II) | 7,69 | 7,69 | 7,69 | 11 |
| Fe(OH) 2 | гидроксид железа(II) (гидроксид железа) | 9,45 | 9,45 | 9,45 | 5 |
| Рт(ОН) 2 | ртути(II) гидроксид | 7.03 | 7.03 | 7.03 | 14 |
| К 2 СО 3 | карбонат калия | 10,52 | 11.00 | 11.36 | |
| KАцетат | ацетат калия (CH 3 COOK) | 7,87 | 8,33 | 8,75 | |
| КНСО 3 | гидрокарбонат калия | 8,27 | 8,25 | 8. 13 13 | |
| КОН | гидроксид калия (калий едкий) | 10,98 | 11,95 | 12,88 | |
| Мг(ОН) 2 | гидроксид магния (MgO:H 2 O) | 10.40 | 10.40 | 10.40 | 3 |
| Нет 2 В 4 О 7 | борат натрия (бура) | 9.21 | 9.17 | 9.05 | |
| Na 2 CO 3 | карбонат натрия (кальцинированная сода) | 10,52 | 10,97 | 11.26 | |
| Na 2 SiO 3 | метасиликат натрия | 11.00 | 11,91 | 12,62 | |
| Нет данных 3 Заказ на поставку 4 | тринатрийфосфат | 10,95 | 11,71 | 12. 12 12 | |
| Ацетат натрия | ацетат натрия (CH 3 COONa) | 7,87 | 8,33 | 8,75 | |
| NaHCO 3 | гидрокарбонат натрия | 8,27 | 8,22 | 8.02 | |
| NaOH | гидроксид натрия | 10,98 | 11,95 | 12,88 | |
| НХ 4 ОХ | гидроксид аммония (NH 3 :Н 2 О) | 10.09 | 10,61 | 11.12 | |
| Ni(ОН) 2 | никеля(II) гидроксид | 8,37 | 8,37 | 8,37 | 9 |
| Pb(OH) 2 | гидроксид свинца(II) | 7,54 | 7,54 | 7,54 | 12 |
| Sr(ОН) 2 | гидроксид стронция | 11. 27 27 | 12.22 | 13.09 | |
| Zn(OH) 2 | гидроксид цинка | 8,88 | 8,88 | 8,88 | 8 |
Примечания и сноски
Гидроксиды являются сильными основаниями, но имеют низкую растворимость, что ограничивает значение pH до верхней границы. Это достигается включением соответствующей твердой фазы в расчет равновесия.
в равновесии с твердой фазой Ba(OH) 2 :8H 2 O ↩ ↩ 2
в равновесии с твердой фазой Портландит ↩ ↩ 2
в равновесии с твердой фазой Брусит ↩ ↩ 2
в равновесии с твердой фазой Кальцит ↩ ↩ 2
в равновесии с твердой фазой Fe(OH) 2 ↩ ↩ 2
в равновесии с твердой фазой Cd(OH) 2 ↩ ↩ 2
в равновесии с твердой фазой Co(OH) 2 ↩ ↩ 2
в равновесии с твердой фазой Zn(OH) 2 -c ↩ ↩ 2
в равновесии с твердой фазой Ni(OH) 2 ↩ ↩ 2
в равновесии с твердой фазой Be(OH) 2 ↩ ↩ 2
в равновесии с твердой фазой Cu(OH) 2 ↩ ↩ 2
в равновесии с твердой фазой Pb(OH) 2 ↩ ↩ 2
в равновесии с твердой фазой Cr(OH) 3 (a) ↩ ↩ 2
в равновесии с твердой фазой Hg(OH) 2 ↩ ↩ 2
[последнее изменение: 17 января 2021 г. ]
]
Кислоты, основания и шкала рН
Эталонные материалы
Кислотные или основные?
Что такое кислота или основание?
Независимо от того, является ли жидкость кислотой или основанием, необходимо иметь дело с ионами водорода (сокращенно химическим символом H + ). В воде (H 2 O) небольшое количество молекул диссоциирует (расщепляется). Некоторые молекулы воды теряют водород и превращаются в ионы гидроксида (ОН — ). «Потерянные» ионы водорода соединяются с молекулами воды, образуя ионы гидроксония (H 3 О + ). Для простоты ионы гидроксония обозначаются как ионы водорода H + . В чистой воде содержится равное количество ионов водорода и гидроксид-ионов. Раствор не является ни кислотным, ни щелочным.
Кислота представляет собой вещество, отдающее ионы водорода. Из-за этого при растворении кислоты в воде баланс между ионами водорода и гидроксид-ионами смещается. Теперь в растворе больше ионов водорода, чем ионов гидроксида. Такой раствор кислый.
Теперь в растворе больше ионов водорода, чем ионов гидроксида. Такой раствор кислый.
Основание — это вещество, которое принимает ионы водорода. При растворении основания в воде баланс между ионами водорода и гидроксид-ионами смещается в противоположную сторону. Поскольку основание «впитывает» ионы водорода, в результате получается раствор с большим количеством ионов гидроксида, чем ионов водорода. Такой раствор является щелочным.
Что такое рН?
Кислотность и щелочность измеряются по логарифмической шкале, называемой pH . Вот почему: в сильнокислом растворе может быть в сто миллионов миллионов или в сто триллионов (100 000 000 000 000) раз больше ионов водорода, чем в сильно щелочном растворе! Обратной стороной, конечно же, является то, что сильно щелочной раствор может содержать в 100 000 000 000 000 раз больше гидроксид-ионов, чем сильнокислый раствор. Более того, концентрации ионов водорода и гидроксид-ионов в повседневных растворах могут варьироваться во всем этом диапазоне.
Чтобы легче было работать с этими большими числами, ученые используют логарифмическую шкалу , шкалу рН. Каждая единица изменения шкалы pH соответствует десятикратному изменению концентрации ионов водорода. Теоретически шкала pH является открытой, но большинство значений pH находится в диапазоне от 0 до 14. Гораздо проще использовать логарифмическую шкалу вместо того, чтобы постоянно записывать все эти нули! Кстати, обратите внимание, что сто миллионов миллионов — это единица с четырнадцатью нулями после нее? Это не совпадения, это логарифмы!
Чтобы быть более точным, pH представляет собой отрицательный логарифм концентрации ионов водорода:
pH = -log [H + ]
Квадратные скобки вокруг H + автоматически означают «концентрация» для химика. Это уравнение означает именно то, о чем мы говорили ранее: при изменении рН на 1 единицу концентрация ионов водорода изменяется в десять раз. Чистая вода имеет нейтральный рН 7. Значения рН ниже 7 являются кислыми, а значения рН выше 7 являются щелочными (основными). В таблице 1 приведены примеры веществ с различными значениями pH (Decelles, 2002; Environment Canada, 2002; EPA, дата неизвестна).
В таблице 1 приведены примеры веществ с различными значениями pH (Decelles, 2002; Environment Canada, 2002; EPA, дата неизвестна).
Общие примеры кислот и оснований
Измерение pH
Как вы измеряете pH?
pH жидкости или раствора часто является важной частью научной информации. Измерение pH может быть выполнено просто и быстро с помощью индикаторной бумаги pH , индикаторной палочки pH или pH-метра . Бумага для тестирования pH и индикаторные палочки представляют собой кусочки бумаги или более жесткие палочки, содержащие индикаторов pH (химические вещества, которые меняют цвет в зависимости от того, насколько кислым или щелочным является раствор). Для измерения рН в жидкость погружают кусочек индикаторной бумаги или индикаторную палочку. Затем цвет смоченной бумаги/палочки сопоставляется с цветовым кодом, который поставляется с контейнером с индикаторной бумагой или индикаторными палочками. Каждый цвет на клавише соответствует своему уровню pH. Пример использованной палочки-индикатора pH и соответствующей цветовой маркировки показан ниже на рисунке 1. pH-метры — это электронные устройства, используемые для измерения pH. Они состоят из зонда, погруженного в раствор, и цифрового считывающего устройства. pH-метры даже более точны, чем pH-метры или индикаторные палочки. В приведенной ниже Таблице 2 обсуждается, какие типы устройств для измерения pH лучше всего подходят для различных научных проектов, а также предлагается быстрая ссылка для приобретения различных индикаторных полосок и индикаторной бумаги для измерения pH.
Пример использованной палочки-индикатора pH и соответствующей цветовой маркировки показан ниже на рисунке 1. pH-метры — это электронные устройства, используемые для измерения pH. Они состоят из зонда, погруженного в раствор, и цифрового считывающего устройства. pH-метры даже более точны, чем pH-метры или индикаторные палочки. В приведенной ниже Таблице 2 обсуждается, какие типы устройств для измерения pH лучше всего подходят для различных научных проектов, а также предлагается быстрая ссылка для приобретения различных индикаторных полосок и индикаторной бумаги для измерения pH.
Чтобы получить точные показания pH, всегда помните:
- Подождите минуту или две после добавления в раствор кислоты или основания. Это позволит завершить реакцию (отдаваемые ионы [кислота] или принимаемые [основание]) до того, как вы измерите.
- Хорошо взболтайте или перемешайте раствор перед измерением. Это поможет обеспечить однородность раствора.
При использовании индикаторной бумаги/индикаторных палочек pH необходимо также:
- Используйте только бумагу/палочки, которые не были предварительно смочены.
 г.
г. - Подождите, пока цвет перестанет меняться (максимум 1–2 минуты), прежде чем сопоставлять бумагу/карандаш с цветовым ключом. Не ждите более 5 минут после стабилизации цвета, иначе он может начать тускнеть, что повлияет на точность показаний.
При использовании рН-метра вы также должны:
- Внимательно прочесть руководство к рН-метру перед его использованием.
- Промывайте датчик рН-метра дистиллированной водой перед каждым измерением.
- Используйте растворы с известными значениями pH, см. Таблицу 2, чтобы убедиться, что pH-метр точно откалиброван. г.
- Прежде чем снимать показания, убедитесь, что датчик pH-метра полностью погружен в раствор.
Библиография
Библиография
Для получения дополнительной информации о кислотах, основаниях и шкале рН воспользуйтесь этой ссылкой:
- Академия Хана. (2009, 7 сентября). Кислоты и основания по Аррениусу. Проверено 15 июля 2021 г.

 И.О. – фамилия, имя, отчество и В.О. – Васильевский остров. Уточним: встречается вариант ФИО без точек. Кроме того есть еще одна петербургская аббревиатура, не попавшая в словарь: П.С. (Петроградская сторона). Все, больше русских точечных аббревиатур нет.
И.О. – фамилия, имя, отчество и В.О. – Васильевский остров. Уточним: встречается вариант ФИО без точек. Кроме того есть еще одна петербургская аббревиатура, не попавшая в словарь: П.С. (Петроградская сторона). Все, больше русских точечных аббревиатур нет. И.О. по привычке, хотя не вижу большого греха и в ФИО, лишь бы заглавными )
И.О. по привычке, хотя не вижу большого греха и в ФИО, лишь бы заглавными )

 В.С. (А.Гайдар) — военно-революционный совет.
В.С. (А.Гайдар) — военно-революционный совет.