Нейролептический дефицитарный синдром | это… Что такое Нейролептический дефицитарный синдром?
Нейролептический дефицитарный синдром, или, иначе, нейролептический дефект, нейролептический дефектный синдром, ятрогенный дефект, нейролептик-индуцированный дефицитарный синдром (Neuroleptic Induced Deficit Syndrome, NIDS) — частый побочный эффект антипсихотических препаратов, особенно в высоких дозах и при длительном приёме. Наиболее часто данный синдром вызывают высокопотентные типичные нейролептики (например, галоперидол, зуклопентиксол), однако атипичные антипсихотики тоже способны его вызывать (особенно те из них, которые более близки по рецепторному профилю к типичным нейролептикам и обладают сильной блокирующей активностью в отношении дофаминовых D2-рецепторов и сравнительно слабой в отношении серотониновых 5-HT2-рецепторов, например рисперидон, амисульприд). По данным на 2005 год, нейролептический дефицитарный синдром встречается примерно у 80% пациентов, принимающих типичные антипсихотики[1].
Содержание
|
Симптоматика
Симптомы нейролептического дефицитарного синдрома чрезвычайно напоминают негативную симптоматику при шизофрении — вялость, двигательная и психическая заторможенность, замедление темпа речи, апатия, cнижение волевых качеств (абулия или гипобулия — буквально означает безволие или слабоволие), снижение уровня энергии («редукция энергетического потенциала»), снижение инициативы, мотивации, побуждений, сужение круга интересов, аутизм, десоциализация, трудности с концентрацией внимания вплоть до полной невозможности сосредоточиться и удерживать внимание на одном предмете (например, читать книги), нарушения памяти, снижение интеллектуальной продуктивности, замедление темпа мышления («тугодумие»), снижение эмоциональной реактивности на внешние стимулы (эмоциональное оскудение или, иначе, эмоциональная холодность) вплоть до полного эмоционального бесчувствия и безразличия, полного отсутствия каких-либо чувств и эмоций. Нередко к такому состоянию присоединяется ятрогенная деперсонализация и/или дереализация, являющаяся защитной реакцией психики на происходящие изменения. Могут наблюдаться и усугублять состояние также сопутствующие экстрапирамидные побочные явления антипсихотической терапии — лекарственный паркинсонизм и/или акатизия. Может также одновременно наблюдаться нейролептическая депрессия (тоска, подавленность, сниженное настроение) или дисфория (раздражительность), или тревожность, бессонница, внутреннее напряжение, беспокойство, связанные с наличием акатизии.
Нередко к такому состоянию присоединяется ятрогенная деперсонализация и/или дереализация, являющаяся защитной реакцией психики на происходящие изменения. Могут наблюдаться и усугублять состояние также сопутствующие экстрапирамидные побочные явления антипсихотической терапии — лекарственный паркинсонизм и/или акатизия. Может также одновременно наблюдаться нейролептическая депрессия (тоска, подавленность, сниженное настроение) или дисфория (раздражительность), или тревожность, бессонница, внутреннее напряжение, беспокойство, связанные с наличием акатизии.
Сходство ятрогенного нейролептического дефекта с истинным, процессуальным шизофреническим дефектом нередко приводит к ошибочной диагностике состояния как обусловленного не побочными эффектами антипсихотиков, а негативной симптоматикой шизофрении. Иногда это приводит даже к ошибочной диагностике самой шизофрении как таковой, при состояниях, не являющихся в действительности шизофренией изначально, но по той или иной причине ошибочно леченных с самого начала антипсихотиками.
Неправильный диагноз соответственно приводит и к неверной тактике лечения — вместо уменьшения доз антипсихотических препаратов или замены препаратов, вызвавших нейролептический дефицитарный синдром, на более «атипичные» препараты с меньшей D2-блокирующей активностью (например, замены оланзапина на кветиапин) или на препарат с наличием частичной D2-агонистической активности (арипипразол), врач может попытаться увеличить их дозу для того, чтобы попытаться «скорректировать» то, что он ошибочно воспринимает как негативные симптомы шизофрении, а не как побочные эффекты антипсихотических препаратов. Между тем, такая лечебная тактика является неверной даже вне зависимости от того, является ли состояние в действительности негативной симптоматикой шизофрении или же ятрогенным нейролептическим дефектом, так как эффективность атипичных антипсихотиков в отношении негативной симптоматики шизофрении (эмоционально-волевого и когнитивного дефицита) ограничена и многими исследователями даже ставится под сомнение, причем эффективность атипичных антипсихотиков в отношении негативной симптоматики скорее обратно коррелирует с D2-блокирующей активностью и зависит от дозы не линейно (то есть клозапин, кветиапин более «антинегативны», чем, например, рисперидон или оланзапин, а низкие дозы оланзапина или рисперидона могут быть более антинегативны, чем высокие). Типичные же и близкие к типичным (рисперидон, амисульприд) антипсихотики вообще на негативную симптоматику не влияют или почти не влияют, а нередко склонны усугублять ее.
Типичные же и близкие к типичным (рисперидон, амисульприд) антипсихотики вообще на негативную симптоматику не влияют или почти не влияют, а нередко склонны усугублять ее.
Так, описан случай 59-летнего японского мужчины с обсессивно-компульсивным расстройством (ОКР), обладавшего определенными преморбидными личностными чертами (подозрительность, параноидная настроенность, замкнутость, недоверчивость, неконтактность), вписывавшимися в картину шизотипического расстройства личности, что привело к ошибочному диагнозу шизофрении (причем наличие у больного депрессии и соответственно депрессивной вялости, апатии, абулии, связанной с прогрессированием ОКР, было истолковано как негативная симптоматика шизофрении), и к назначению этому больному галоперидола. Однако состояние больного при этом лечении не только не улучшилось, но и стало хуже. Несмотря на это, врачи продолжали наращивать ему дозу галоперидола, а затем присоединяли другие антипсихотики (не отменяя при этом галоперидол). Ухудшение трактовалось как нарастание негативной симптоматики шизофрении и приводило к дальнейшему наращиванию доз антипсихотиков. На момент поступления в стационар г. Токио у больного имелся тяжелый нейролептический дефект, выражавшийся, в частности, в замедленном мышлении, трудностях с концентрацией внимания, эмоциональном оскудении, дисфории, а также сопутствующий нейролептический паркинсонизм. С целью уменьшения тяжести этого состояния врачи стационара в Токио постепенно уменьшили ему дозу антипсихотиков и перевели с антипсихотического коктейля на монотерапию рисперидоном. При этом состояние больного улучшилось, и никакого ухудшения ОКР-симптоматики или шизоидных личностных черт отмечено не было. Впоследствии рисперидон был полностью отменен, назначен антидепрессант флувоксамин (группа СИОЗС), являющийся стандартным лечением ОКР, а диагноз больного был изменен с шизофрении на ОКР на фоне преморбидной шизоидной личности. Состояние больного резко улучшилось.[2]
На момент поступления в стационар г. Токио у больного имелся тяжелый нейролептический дефект, выражавшийся, в частности, в замедленном мышлении, трудностях с концентрацией внимания, эмоциональном оскудении, дисфории, а также сопутствующий нейролептический паркинсонизм. С целью уменьшения тяжести этого состояния врачи стационара в Токио постепенно уменьшили ему дозу антипсихотиков и перевели с антипсихотического коктейля на монотерапию рисперидоном. При этом состояние больного улучшилось, и никакого ухудшения ОКР-симптоматики или шизоидных личностных черт отмечено не было. Впоследствии рисперидон был полностью отменен, назначен антидепрессант флувоксамин (группа СИОЗС), являющийся стандартным лечением ОКР, а диагноз больного был изменен с шизофрении на ОКР на фоне преморбидной шизоидной личности. Состояние больного резко улучшилось.[2]
Патогенез
Патогенез (причины) нейролептического дефицитарного синдрома связывают с избыточной блокадой дофаминергических рецепторов в префронтальных и фронтальных долях коры (что приводит к когнитивным нарушениям и развитию апато-абулического синдрома, аналогичного по патогенезу апато-абулии при шизофрении и тоже связанного со снижением дофаминергической нейропередачи в лобных долях), в лимбической системе (что приводит к снижению эмоциональной реактивности, эмоциональному оскудению и отупению, безразличию, к развитию нейролептической депрессии или дисфории), в гиппокампе (что приводит к нарушениям памяти) и в нигростриарной системе (что приводит к развитию сопутствующих экстрапирамидных нарушений — лекарственного паркинсонизма и акатизии).
Течение
Однажды возникнув, нейролептический дефицитарный синдром, как правило, остается неизменным или даже прогрессирует (усиливается) в течение всего срока приема антипсихотика при стабильной дозе антипсихотика, усиливается при повышении его дозы, но может уменьшиться (редуцироваться) или полностью исчезнуть при снижении дозы антипсихотического препарата или при замене его на «более атипичный», менее мощный, «более мягкий» препарат с меньшей D2-блокирующей активностью, при назначении дофаминергических агентов (бромокриптин, селегилин, амантадин, прамипексол, проноран) или антидепрессантов, при увеличении дозы холинолитических корректоров (тригексифенидила или биперидена). Однако в некоторых случаях, особенно при длительном (многомесячном и особенно многолетнем) лечении высокопотентными типичными антипсихотиками, нейролептический дефицитарный синдром может стать необратимым и остаться у больного навсегда и после отмены антипсихотиков (подобно необратимым поздним дискинезиям), поздней акатизии, поздним нейролептическим психозам гиперчувствительности — поздней дисфрении. Тем не менее, даже в необратимых случаях выраженность нейролептического дефекта нередко уменьшается с течением времени после отмены мощного антипсихотика или замены его на более атипичный и менее потентный препарат.
Тем не менее, даже в необратимых случаях выраженность нейролептического дефекта нередко уменьшается с течением времени после отмены мощного антипсихотика или замены его на более атипичный и менее потентный препарат.
Лечение
Лечение нейролептического дефицитарного синдрома заключается в уменьшении дозы антипсихотиков, в отмене антипсихотических коктейлей (переводе на монотерапию одним антипсихотиком) и/или переводе на «более атипичный», «более мягкий», менее высокопотентный антипсихотик (если это позволяет психическое состояние больного), а также в назначении антидепрессантов для коррекции сопутствующей нейролептической депрессии, в назначении или повышении дозы антипаркинсонических препаратов (холинолитических корректоров), дофаминергических агентов для коррекции сопутствующих экстрапирамидных нарушений, акатизии, гиперпролактинемии, нарушений либидо и сексуальной функции и др.
См. также
- Нейролептический паркинсонизм
- Нейролептические экстрапирамидные расстройства
- Синдром отмены антипсихотиков
Ссылки
- ↑ Иванов М.
 В. «Идеальный антипсихотик» для лечения шизофрении: реальность или/и иллюзии. — Санкт-Петербург, 27.10.2011. — С. 18. — 30 с.
В. «Идеальный антипсихотик» для лечения шизофрении: реальность или/и иллюзии. — Санкт-Петербург, 27.10.2011. — С. 18. — 30 с. - ↑ Machida N Случай обсессивно-компульсивного расстройства у шизоидной личности.
Нейролептический дефицитарный синдром | это… Что такое Нейролептический дефицитарный синдром?
Нейролептический дефицитарный синдром, или, иначе, нейролептический дефект, нейролептический дефектный синдром, ятрогенный дефект, нейролептик-индуцированный дефицитарный синдром
(Neuroleptic Induced Deficit Syndrome, NIDS) — частый побочный эффект антипсихотических препаратов, особенно в высоких дозах и при длительном приёме. Наиболее часто данный синдром вызывают высокопотентные типичные нейролептики (например, галоперидол, зуклопентиксол), однако атипичные антипсихотики тоже способны его вызывать (особенно те из них, которые более близки по рецепторному профилю к типичным нейролептикам и обладают сильной блокирующей активностью в отношении дофаминовых D2-рецепторов и сравнительно слабой в отношении серотониновых 5-HT2-рецепторов, например рисперидон, амисульприд). По данным на 2005 год, нейролептический дефицитарный синдром встречается примерно у 80% пациентов, принимающих типичные антипсихотики[1].
По данным на 2005 год, нейролептический дефицитарный синдром встречается примерно у 80% пациентов, принимающих типичные антипсихотики[1].Содержание
|
Симптоматика
Симптомы нейролептического дефицитарного синдрома чрезвычайно напоминают негативную симптоматику при шизофрении — вялость, двигательная и психическая заторможенность, замедление темпа речи, апатия, cнижение волевых качеств (абулия или гипобулия — буквально означает безволие или слабоволие), снижение уровня энергии («редукция энергетического потенциала»), снижение инициативы, мотивации, побуждений, сужение круга интересов, аутизм, десоциализация, трудности с концентрацией внимания вплоть до полной невозможности сосредоточиться и удерживать внимание на одном предмете (например, читать книги), нарушения памяти, снижение интеллектуальной продуктивности, замедление темпа мышления («тугодумие»), снижение эмоциональной реактивности на внешние стимулы (эмоциональное оскудение или, иначе, эмоциональная холодность) вплоть до полного эмоционального бесчувствия и безразличия, полного отсутствия каких-либо чувств и эмоций. Нередко к такому состоянию присоединяется ятрогенная деперсонализация и/или дереализация, являющаяся защитной реакцией психики на происходящие изменения. Могут наблюдаться и усугублять состояние также сопутствующие экстрапирамидные побочные явления антипсихотической терапии — лекарственный паркинсонизм и/или акатизия. Может также одновременно наблюдаться нейролептическая депрессия (тоска, подавленность, сниженное настроение) или дисфория (раздражительность), или тревожность, бессонница, внутреннее напряжение, беспокойство, связанные с наличием акатизии.
Нередко к такому состоянию присоединяется ятрогенная деперсонализация и/или дереализация, являющаяся защитной реакцией психики на происходящие изменения. Могут наблюдаться и усугублять состояние также сопутствующие экстрапирамидные побочные явления антипсихотической терапии — лекарственный паркинсонизм и/или акатизия. Может также одновременно наблюдаться нейролептическая депрессия (тоска, подавленность, сниженное настроение) или дисфория (раздражительность), или тревожность, бессонница, внутреннее напряжение, беспокойство, связанные с наличием акатизии.
Сходство ятрогенного нейролептического дефекта с истинным, процессуальным шизофреническим дефектом нередко приводит к ошибочной диагностике состояния как обусловленного не побочными эффектами антипсихотиков, а негативной симптоматикой шизофрении. Иногда это приводит даже к ошибочной диагностике самой шизофрении как таковой, при состояниях, не являющихся в действительности шизофренией изначально, но по той или иной причине ошибочно леченных с самого начала антипсихотиками.
Неправильный диагноз соответственно приводит и к неверной тактике лечения — вместо уменьшения доз антипсихотических препаратов или замены препаратов, вызвавших нейролептический дефицитарный синдром, на более «атипичные» препараты с меньшей D2-блокирующей активностью (например, замены оланзапина на кветиапин) или на препарат с наличием частичной D2-агонистической активности (арипипразол), врач может попытаться увеличить их дозу для того, чтобы попытаться «скорректировать» то, что он ошибочно воспринимает как негативные симптомы шизофрении, а не как побочные эффекты антипсихотических препаратов. Между тем, такая лечебная тактика является неверной даже вне зависимости от того, является ли состояние в действительности негативной симптоматикой шизофрении или же ятрогенным нейролептическим дефектом, так как эффективность атипичных антипсихотиков в отношении негативной симптоматики шизофрении (эмоционально-волевого и когнитивного дефицита) ограничена и многими исследователями даже ставится под сомнение, причем эффективность атипичных антипсихотиков в отношении негативной симптоматики скорее обратно коррелирует с D2-блокирующей активностью и зависит от дозы не линейно (то есть клозапин, кветиапин более «антинегативны», чем, например, рисперидон или оланзапин, а низкие дозы оланзапина или рисперидона могут быть более антинегативны, чем высокие). Типичные же и близкие к типичным (рисперидон, амисульприд) антипсихотики вообще на негативную симптоматику не влияют или почти не влияют, а нередко склонны усугублять ее.
Типичные же и близкие к типичным (рисперидон, амисульприд) антипсихотики вообще на негативную симптоматику не влияют или почти не влияют, а нередко склонны усугублять ее.
Так, описан случай 59-летнего японского мужчины с обсессивно-компульсивным расстройством (ОКР), обладавшего определенными преморбидными личностными чертами (подозрительность, параноидная настроенность, замкнутость, недоверчивость, неконтактность), вписывавшимися в картину шизотипического расстройства личности, что привело к ошибочному диагнозу шизофрении (причем наличие у больного депрессии и соответственно депрессивной вялости, апатии, абулии, связанной с прогрессированием ОКР, было истолковано как негативная симптоматика шизофрении), и к назначению этому больному галоперидола. Однако состояние больного при этом лечении не только не улучшилось, но и стало хуже. Несмотря на это, врачи продолжали наращивать ему дозу галоперидола, а затем присоединяли другие антипсихотики (не отменяя при этом галоперидол). Ухудшение трактовалось как нарастание негативной симптоматики шизофрении и приводило к дальнейшему наращиванию доз антипсихотиков. На момент поступления в стационар г. Токио у больного имелся тяжелый нейролептический дефект, выражавшийся, в частности, в замедленном мышлении, трудностях с концентрацией внимания, эмоциональном оскудении, дисфории, а также сопутствующий нейролептический паркинсонизм. С целью уменьшения тяжести этого состояния врачи стационара в Токио постепенно уменьшили ему дозу антипсихотиков и перевели с антипсихотического коктейля на монотерапию рисперидоном. При этом состояние больного улучшилось, и никакого ухудшения ОКР-симптоматики или шизоидных личностных черт отмечено не было. Впоследствии рисперидон был полностью отменен, назначен антидепрессант флувоксамин (группа СИОЗС), являющийся стандартным лечением ОКР, а диагноз больного был изменен с шизофрении на ОКР на фоне преморбидной шизоидной личности. Состояние больного резко улучшилось.[2]
На момент поступления в стационар г. Токио у больного имелся тяжелый нейролептический дефект, выражавшийся, в частности, в замедленном мышлении, трудностях с концентрацией внимания, эмоциональном оскудении, дисфории, а также сопутствующий нейролептический паркинсонизм. С целью уменьшения тяжести этого состояния врачи стационара в Токио постепенно уменьшили ему дозу антипсихотиков и перевели с антипсихотического коктейля на монотерапию рисперидоном. При этом состояние больного улучшилось, и никакого ухудшения ОКР-симптоматики или шизоидных личностных черт отмечено не было. Впоследствии рисперидон был полностью отменен, назначен антидепрессант флувоксамин (группа СИОЗС), являющийся стандартным лечением ОКР, а диагноз больного был изменен с шизофрении на ОКР на фоне преморбидной шизоидной личности. Состояние больного резко улучшилось.[2]
Патогенез
Патогенез (причины) нейролептического дефицитарного синдрома связывают с избыточной блокадой дофаминергических рецепторов в префронтальных и фронтальных долях коры (что приводит к когнитивным нарушениям и развитию апато-абулического синдрома, аналогичного по патогенезу апато-абулии при шизофрении и тоже связанного со снижением дофаминергической нейропередачи в лобных долях), в лимбической системе (что приводит к снижению эмоциональной реактивности, эмоциональному оскудению и отупению, безразличию, к развитию нейролептической депрессии или дисфории), в гиппокампе (что приводит к нарушениям памяти) и в нигростриарной системе (что приводит к развитию сопутствующих экстрапирамидных нарушений — лекарственного паркинсонизма и акатизии).
Течение
Однажды возникнув, нейролептический дефицитарный синдром, как правило, остается неизменным или даже прогрессирует (усиливается) в течение всего срока приема антипсихотика при стабильной дозе антипсихотика, усиливается при повышении его дозы, но может уменьшиться (редуцироваться) или полностью исчезнуть при снижении дозы антипсихотического препарата или при замене его на «более атипичный», менее мощный, «более мягкий» препарат с меньшей D2-блокирующей активностью, при назначении дофаминергических агентов (бромокриптин, селегилин, амантадин, прамипексол, проноран) или антидепрессантов, при увеличении дозы холинолитических корректоров (тригексифенидила или биперидена). Однако в некоторых случаях, особенно при длительном (многомесячном и особенно многолетнем) лечении высокопотентными типичными антипсихотиками, нейролептический дефицитарный синдром может стать необратимым и остаться у больного навсегда и после отмены антипсихотиков (подобно необратимым поздним дискинезиям), поздней акатизии, поздним нейролептическим психозам гиперчувствительности — поздней дисфрении. Тем не менее, даже в необратимых случаях выраженность нейролептического дефекта нередко уменьшается с течением времени после отмены мощного антипсихотика или замены его на более атипичный и менее потентный препарат.
Тем не менее, даже в необратимых случаях выраженность нейролептического дефекта нередко уменьшается с течением времени после отмены мощного антипсихотика или замены его на более атипичный и менее потентный препарат.
Лечение
Лечение нейролептического дефицитарного синдрома заключается в уменьшении дозы антипсихотиков, в отмене антипсихотических коктейлей (переводе на монотерапию одним антипсихотиком) и/или переводе на «более атипичный», «более мягкий», менее высокопотентный антипсихотик (если это позволяет психическое состояние больного), а также в назначении антидепрессантов для коррекции сопутствующей нейролептической депрессии, в назначении или повышении дозы антипаркинсонических препаратов (холинолитических корректоров), дофаминергических агентов для коррекции сопутствующих экстрапирамидных нарушений, акатизии, гиперпролактинемии, нарушений либидо и сексуальной функции и др.
См. также
- Нейролептический паркинсонизм
- Нейролептические экстрапирамидные расстройства
- Синдром отмены антипсихотиков
Ссылки
- ↑ Иванов М.
 В. «Идеальный антипсихотик» для лечения шизофрении: реальность или/и иллюзии. — Санкт-Петербург, 27.10.2011. — С. 18. — 30 с.
В. «Идеальный антипсихотик» для лечения шизофрении: реальность или/и иллюзии. — Санкт-Петербург, 27.10.2011. — С. 18. — 30 с. - ↑ Machida N Случай обсессивно-компульсивного расстройства у шизоидной личности.
Злокачественный нейролептический синдром (ЗНС) — PsychDB
Содержание
Злокачественный нейролептический синдром (ЗНС)
Грунтовка
Противоправные лекарства
Нейролептики
Ненейролептики
Прекращение терапии агонистами допамина
Патофизиология
Диагностика
- Расследования
Дифференциальная диагностика
Лечение
Принципы
Фармакотерапия
ЕСТ
Ресурсы
Грунтовка
Злокачественный нейролептический синдром (ЗНС) представляет собой опасную для жизни идиосинкразическую реакцию на антагонисты дофамина (чаще всего, но не всегда, нейролептики), характеризующуюся лихорадкой, измененным психическим статусом, мышечной ригидностью и вегетативной дисфункцией. Предполагается, что это связано с чрезмерной блокадой дофаминовых рецепторов. Некоторые люди могут подвергаться более высокому риску развития ЗНС.
Предполагается, что это связано с чрезмерной блокадой дофаминовых рецепторов. Некоторые люди могут подвергаться более высокому риску развития ЗНС.
Эпидемиология
Прогноз
Большинство случаев ЗНС развиваются в течение 24 часов после начала приема препарата и/или в течение первой недели, и практически все случаи развиваются в течение 30 дней.
Смертность от ЗНС может достигать 10-20%, если ее не распознать. Среднее время выздоровления после отмены препарата составляет 7-10 дней, при этом большинство людей выздоравливают в течение 1 недели и почти все в течение 30 дней.
Продолжительность может быть увеличена, если речь идет о длительно действующих нейролептиках. Остаточные неврологические симптомы могут сохраняться в течение нескольких недель после разрешения острых гиперметаболических симптомов.
У пациентов обычно не возникает рецидива ЗНС при повторном приеме нейролептиков, но существует незначительный риск, особенно при повторном назначении антипсихотиков вскоре после эпизода ЗНС.

Факторы риска
Любой человек, начинающий прием антагониста дофамина, имеет потенциальный риск развития ЗНС. ЗНС не является специфическим для какого-либо нервно-психического расстройства и может возникать у лиц без психических расстройств, принимающих антагонисты дофамина.
Возбуждение, истощение, обезвоживание, дефицит железа являются факторами повышенного риска ЗНС.
Негативные факторы, такие как парентеральное введение, быстрое титрование и более высокие общие дозы лекарств, также связаны с повышенным риском, но большинство случаев ЗНС возникают в диапазоне терапевтических доз нейролептиков.
Противоправные препараты
Нейролептики
Любой человек, начавший принимать нейролептики, имеет потенциальный риск развития ЗНС. Почти все антагонисты дофамина могут вызывать ЗНС, а сильнодействующие антипсихотики представляют больший риск по сравнению с слабодействующими средствами и атипичными нейролептиками.
Неантипсихотические препараты
Непсихотропные антагонисты дофамина, такие как метоклопрамид и прохлорперазин, также вызывают ЗНС.
Прекращение терапии агонистами дофамина
ЗНС также может наблюдаться у пациентов с болезнью Паркинсона при отмене терапии L-Dopa или агонистами дофамина, снижении дозы или переходе с одного агониста дофамина на другой.
Патофизиология
Полный патофизиологический процесс, лежащий в основе ЗНС, изучен недостаточно. ЗНС может возникать как при использовании антагонистов дофамина, так и при отмене/снижении дозы противопаркинсонических препаратов, таких как леводопа или терапия агонистами дофамина.
Модель антагонизма к дофаминовым рецепторам D2 при ЗНС предполагает, что чрезмерная блокада центральных рецепторов D2 в гипоталамусе, нигростриарных путях и спинном мозге приводит к гипертермии, мышечной ригидности, вегетативной нестабильности и тремору.

ЗНС имеет сходные симптомы со злокачественной гипертермией, но это совершенно разные состояния с разной этиологией. Напротив, считается, что злокачественная кататония связана с ЗНС, при этом ЗНС по существу является ятрогенной формой злокачественной кататонии.
Диагностика
Злокачественный нейролептический синдром (ЗНС) необходимо диагностировать незамедлительно, чтобы избежать серьезной травмы или смерти, но нет единого мнения о диагностических критериях этого расстройства. В Международном консенсусном исследовании диагностических критериев злокачественного нейролептического синдрома 2011 г. были предложены следующие согласованные критерии:
Недавняя отмена агонистов дофамина или прием антагонистов дофамина (в течение последних 72 часов)
- Гипертермия (> 38°C по крайней мере при
Жесткость («свинцовая труба»)
Изменение психического статуса (снижение или колебания уровня сознания)
Повышение уровня креатинкиназы (CK) (как минимум в 4 раза выше верхней границы нормы)
- Лабильность симпатической нервной системы , определяемая как минимум
2из следующего:Артериальное давление Повышение (САД или ДАД ≥ 25% выше исходного уровня)
Кровяное давление колебания (систолическое изменение ≥ 20 мм рт.
 ст. в течение 24 часов)
ст. в течение 24 часов)Диафорез
Недержание мочи
Гиперметаболизм
, определяемый как увеличение частоты сердечных сокращений (≥ 25% выше исходного уровня) И увеличение частоты дыхания (≥ 50% выше исходного уровня)Отрицательные результаты обследования на инфекционные, токсические, метаболические или неврологические причины
Мнемоника
Мнемоника ЛИХОРАДКА может использоваться для запоминания клинических и лабораторных признаков ЗНС:-
F 901 74 - Лихорадка -
E- Энцефалопатия (спутанность сознания, изменения психического статуса) -
V- Нестабильность основных показателей жизнедеятельности (тахикардия, тахипноэ и/или лабильное артериальное давление) -
E- Повышение уровня ферментов (повышение уровня креатининфосфокиназы [КФК] из-за рабдомиолиза) -
Р- Рабдомиолиз (вызванный мышечной ригидностью, что отличает ЗНС от других токсидромов, таких как серотониновый синдром и антихолинергическая токсичность) -
R- Ригидность Общая ригидность мышц «свинцовой трубы»
Исследования
См. Также Статья: Делирий и Аутоиммунный энцефалит
Также Статья: Делирий и Аутоиммунный энцефалит
. У лиц с ЗНС могут наблюдаться лейкоцитоз, метаболический ацидоз, гипоксия, снижение концентрации железа в сыворотке крови и повышение уровня мышечных ферментов и катехоламинов в сыворотке крови. Анализ спинномозговой жидкости и нейровизуализационные исследования обычно ничем не примечательны, тогда как электроэнцефалография показывает общее замедление.
Стандартный анализ крови может включать сывороточное железо, КК, электролиты, лейкоциты, температуру, трансаминазы печени (АСТ, АЛТ, ЛДГ).
Дифференциальная диагностика
См. также статью: Введение в токсидромы
ЗНС должен быть диагнозом исключения и должен быть дифференцирован с другими серьезными неврологическими или медицинскими состояниями, включая инфекции центральной нервной системы, воспалительные или аутоиммунные состояния, эпилептический статус, подкорковые структурные поражения и системные состояния (например, феохромоцитома, тиреотоксикоз, столбняк, жар).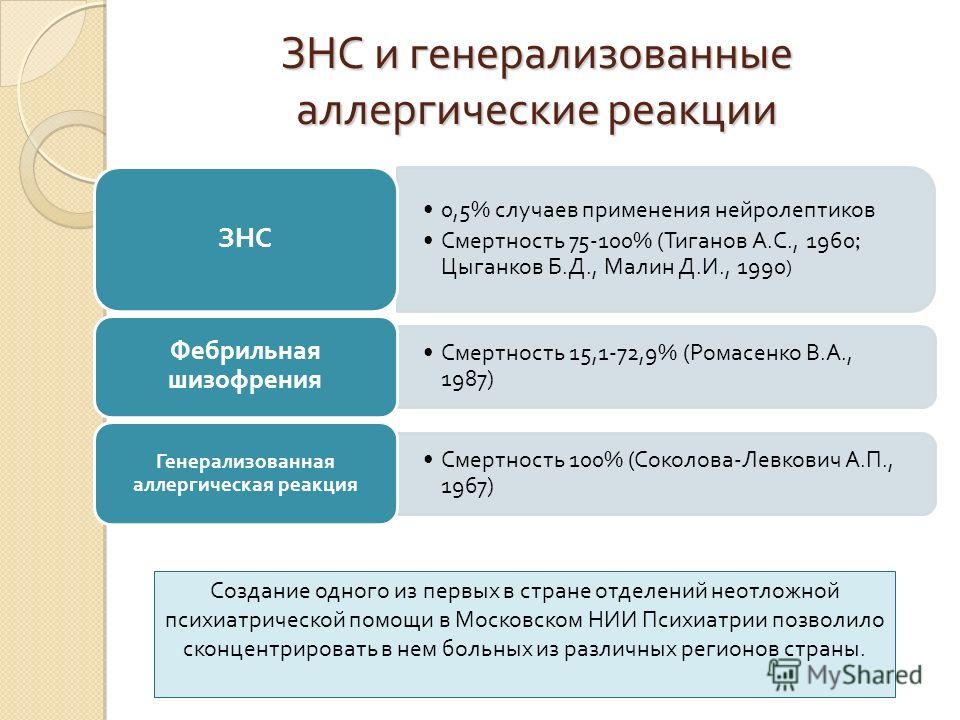 гладить).
гладить).
Серотониновый синдром
Паркинсонический гипертермический синдром
Отказ от алкоголя или седативных средств
Злокачественная гипертермия , возникающая во время анестезии
Гипертермия, связанная со злоупотреблением стимуляторами и галлюциногенами
Отравление атропином
Злокачественная кататония
Может быть неотличим от NMS. ЗНС считается лекарственно-индуцированной (ятрогенной) формой злокачественной кататонии.
Лечение
Принципы
Раннее распознавание ЗНС является ключом к хорошим результатам. Все антагонисты допамина должны быть немедленно отменены при подозрении на ЗНС. Поддерживающая терапия включает восполнение жидкости, поддержку функции сердца, легких и почек, а также снижение температуры. Отслеживание тенденций и мониторинг лейкоцитов, КК, температуры, сывороточного железа и трансаминаз печени (АСТ, АЛТ, ЛДГ) может помочь контролировать выздоровление пациента.
Отслеживание тенденций и мониторинг лейкоцитов, КК, температуры, сывороточного железа и трансаминаз печени (АСТ, АЛТ, ЛДГ) может помочь контролировать выздоровление пациента.
Фармакотерапия
Бромокриптин, продофаминергический и просеротернергический агент
Амантадин
Дантролен
ECT
Ресурсы
Берман, Б. Д. (2011). Злокачественный нейролептический синдром: обзор для нейрогоспиталистов. Нейрогоспиталист, 1(1), 41-47.
нейролептики
Ссылки
1) Американская психиатрическая ассоциация. (2013). Диагностическое и статистическое руководство по психическим расстройствам (5-е изд.). Арлингтон, Вирджиния.
2) Keyser, D.L., & Rodnitzky, R.L. (1991). Злокачественный нейролептический синдром при болезни Паркинсона после отмены или изменения дофаминергической терапии. Архив внутренней медицины, 151 (4), 794-796.
3) Кек П.Е., Карофф С.Н. и МакЭлрой С.Л. (1995). Злокачественный нейролептический синдром и злокачественная гипертермия: конец полемики? Журнал нейропсихиатрии и клинических нейронаук.
4) Литман Р. С. (2017). Запутанная терминология — злокачественный нейролептический синдром против злокачественной гипертермии. JAMA неврология, 74 (8), 1012-1013.
5) Гуррера, Р. Дж., Карофф, С. Н., Коэн, А., Кэрролл, Б. Т., ДеРоос, Ф., Фрэнсис, А., Фрухт, С., Гупта, С., Левенсон, Дж. Л., Махмуд , А., Манн, С.К., Поликастро, М.А., Роузбуш, П.И., Розенберг, Х., Сачдев, П.С., Троллор, Дж.Н., Веламур, В.Р., Уотсон, С.Б., и Уилкинсон, Дж.Р. (2011). Международное консенсусное исследование критериев диагностики злокачественного нейролептического синдрома с использованием метода Дельфи. Журнал клинической психиатрии, 72(9).), 1222–1228.
6) Берман Б.Д. (2011). Злокачественный нейролептический синдром: обзор для нейрогоспиталистов. Нейрогоспиталист, 1(1), 41-47.
Нейрогоспиталист, 1(1), 41-47.
Злокачественный нейролептический синдром у подростка с дефицитом CYP2D6
Резюме
Мы описываем пациента с дистонией и психотическими симптомами, получавшего стандартные дозы антипсихотических препаратов, у которого развился злокачественный нейролептический синдром (ЗНС). У 16-летнего мужчины, злоупотреблявшего декстрометорфаном и псевдоэфедрином в рекреационных целях, развилась дистония и психотический эпизод. После непрерывного лечения оланзапином (10 мг/сут), повторных инъекций левомепромазина (37,5 мг/сут) и однократной инъекции галоперидола (2,5 мг) у пациента развился НМС. Мышечная ригидность, лихорадка (до 41°C), гипотензия (100/70 мм рт.ст.), тахикардия (120 ударов в минуту), тахипноэ (26 вдохов в минуту), повышение количества лейкоцитов (до 16,6 × 10 3 / мкл), и наблюдалось повышение уровня креатининфосфокиназы (КФК) в сыворотке (до 15 255 Ед/л). Диагноз ЗНС ставился в соответствии с критериями DSM-IV TR. Генотипирование показало, что он гомозиготен по нефункциональному аллелю CYP2D6*4. Случай подчеркивает важность терапевтического лекарственного мониторинга в выявлении и дифференциации вызванных лекарствами эффектов при психических расстройствах для предотвращения ЗНС и его осложнений. Кроме того, генотипирование CYP2D6 может быть рассмотрено у пациентов с симптомами, указывающими на токсичность лекарств, которые лечатся нейролептиками, метаболизирующимися через путь CYP2D6, поскольку носительство одного или нескольких нефункциональных аллелей может увеличить риск побочных реакций, таких как ЗНС.
Случай подчеркивает важность терапевтического лекарственного мониторинга в выявлении и дифференциации вызванных лекарствами эффектов при психических расстройствах для предотвращения ЗНС и его осложнений. Кроме того, генотипирование CYP2D6 может быть рассмотрено у пациентов с симптомами, указывающими на токсичность лекарств, которые лечатся нейролептиками, метаболизирующимися через путь CYP2D6, поскольку носительство одного или нескольких нефункциональных аллелей может увеличить риск побочных реакций, таких как ЗНС.
Введение
Применение атипичных нейролептиков в педиатрической популяции во всем мире в последние годы резко возросло [1]. Злокачественный нейролептический синдром (ЗНС) — редкое, но потенциально фатальное осложнение лечения нейролептиками. Клинические признаки ЗНС включают мышечную ригидность, гипертермию, вегетативную нестабильность, изменения психического статуса и признаки мышечного катаболизма [2]. Одна из гипотез относительно его этиологии постулирует, что предрасположенность к ЗНС может быть связана с вариациями генов, кодирующих метаболические ферменты [7]. Мы сообщаем о педиатрическом пациенте, у которого развился ЗНС во время лечения стандартными дозами нейролептиков из-за острого психотического эпизода. Клиническое наблюдение показало токсичность препарата из-за нарушения метаболизма препарата. Генотипирование гена CYP2D6 подтверждено носительство двух дисфункциональных аллелей.
Мы сообщаем о педиатрическом пациенте, у которого развился ЗНС во время лечения стандартными дозами нейролептиков из-за острого психотического эпизода. Клиническое наблюдение показало токсичность препарата из-за нарушения метаболизма препарата. Генотипирование гена CYP2D6 подтверждено носительство двух дисфункциональных аллелей.
История болезни
В сентябре 2009 года 16-летний мужчина (вес: 65,5 кг, рост: 1,83 м, ИМТ = 19,6 кг/м 2 ) был госпитализирован в детское неврологическое отделение из-за дистонии. За месяц до этого больной стал замкнутым, появились бессонница, скручивание левых конечностей. Эти симптомы появились после 1-месячного периода использования лекарств, содержащих декстрометорфан и псевдоэфедрин, в рекреационных целях. При поступлении в отделение детской неврологии хорошо ориентировался, выполнял инструкции. Неврологическое обследование не выявило никаких изменений, за исключением стойкого скручивания левых конечностей. Результаты лабораторных исследований, электроэнцефалографии (ЭЭГ) и компьютерной томографии головы и шеи были в норме. Во время госпитализации его психическое состояние ухудшилось. Он стал запутанным и нелогичным. Консультирующий психиатр диагностировал психотический эпизод и перевел пациентку в подростковое стационарное психиатрическое отделение.
Во время госпитализации его психическое состояние ухудшилось. Он стал запутанным и нелогичным. Консультирующий психиатр диагностировал психотический эпизод и перевел пациентку в подростковое стационарное психиатрическое отделение.
Во время перевода пациент был в сознании, у него были бредовые мысли и галлюцинации. Было начато лечение перорально вводимыми оланзапином (10 мг/день) и лоразепамом (при необходимости) с внутримышечными инъекциями антипсихотического препарата первого поколения — левомепромазина (25 мг/день). На следующий день доза левомепромазина была увеличена до 37,5 мг/сут. В процессе лечения дистонические движения ухудшились. Наблюдались опистотоническое разгибание туловища, прерывистые, устойчивые разгибательные движения рук и непонятные крики. Пациент не имел вербального общения с медперсоналом, был возбужден, не мог спать, отказывался от еды и питья. Внутривенно вводили жидкости для обезвоживания. Через 2 недели лечения у него появилась сонливость со снижением физической активности. В связи с повторяющимися эпизодами возбуждения пациент получал 1–3 мг/сут лоразепама. Эпизод агрессии по отношению к медицинскому персоналу потребовал однократного внутримышечного введения галоперидола (2,5 мг). Хронология представленных симптомов и назначенных лекарств показана на рис. 1. На 16-й день лечения нейролептиками пациент был переведен в отделение детской психиатрии университета.
В связи с повторяющимися эпизодами возбуждения пациент получал 1–3 мг/сут лоразепама. Эпизод агрессии по отношению к медицинскому персоналу потребовал однократного внутримышечного введения галоперидола (2,5 мг). Хронология представленных симптомов и назначенных лекарств показана на рис. 1. На 16-й день лечения нейролептиками пациент был переведен в отделение детской психиатрии университета.
Хронология представленных симптомов и введенных лекарств до поступления в отделение интенсивной терапии
Изображение в полный размер
Во время этого перевода пациент был без сознания, у него наблюдалась мышечная ригидность и экстрапирамидные симптомы. Отмечались лихорадка (до 41°С), артериальная гипотензия (100/70 мм рт.ст.), тахикардия (120 ударов в минуту), тахипноэ (26 вдохов в минуту). Лабораторный анализ показал количество лейкоцитов (WBC) 13,40 × 10 3 / мкл, уровень креатининфосфокиназы (КФК) в сыворотке 639 ЕД/л и нормальные тесты функции печени и почек.
На следующий день у пациента появилось потоотделение с 7 баллами по шкале комы Глазго (диапазон 3–15 баллов), указывающими на состояние комы. КФК увеличился до 2458 ЕД/л, лейкоцитов до 16,6 × 10 3 /мкл, креатинина (SCC) до 1,70 мг/дл и азота мочевины крови (АМК) до 79,0 мг/дл. Больной переведен в отделение интенсивной терапии (ОИТ), интубирован и переведен на искусственную вентиляцию легких в связи с дыхательной недостаточностью. Наблюдались генерализованные тонико-клонические судороги. Ацикловир вводили при потенциальном герпесном энцефалите и дантролен для противодействия потенциальному ЗНС. На электрокардиограмме выявлена элевация сегмента ST с инверсией зубца Т. Повышенные уровни тропонина и миоглобина, обнаруженные в моче, свидетельствовали о поражении миокарда. Эхокардиограмма показала гипокинез левого желудочка. Уровни КФК в сыворотке продолжали расти в течение следующих 6 дней и достигли пика 15 255 Ед/л. BUN и SCC также увеличились за 3 дня до 79.0,6 и 2,1 мг/дл соответственно. Органическая патология головного мозга была исключена после повторных нормальных магнитно-резонансных изображений и исследования спинномозговой жидкости (концентрация глюкозы 70,0 мг/дл, концентрация белка 34 мг/дл, отсутствие клеток). Полимеразная цепная реакция (ПЦР) исключила инфекцию, вызванную вирусом простого герпеса, и прием ацикловира был прекращен. Через шесть недель после последнего введения нейролептиков была проведена токсикология мочи. Обнаружено присутствие галоперидола, но не оланзапина. Присутствие левомепромазина не измеряли. Тестов для измерения концентрации лекарственного средства в плазме не проводилось. ПЦР в реальном времени показала, что генотип CYP2D6 был *4/*4. Эти результаты указывают на отсутствие активности CYP2D6.
Органическая патология головного мозга была исключена после повторных нормальных магнитно-резонансных изображений и исследования спинномозговой жидкости (концентрация глюкозы 70,0 мг/дл, концентрация белка 34 мг/дл, отсутствие клеток). Полимеразная цепная реакция (ПЦР) исключила инфекцию, вызванную вирусом простого герпеса, и прием ацикловира был прекращен. Через шесть недель после последнего введения нейролептиков была проведена токсикология мочи. Обнаружено присутствие галоперидола, но не оланзапина. Присутствие левомепромазина не измеряли. Тестов для измерения концентрации лекарственного средства в плазме не проводилось. ПЦР в реальном времени показала, что генотип CYP2D6 был *4/*4. Эти результаты указывают на отсутствие активности CYP2D6.
Поскольку другие состояния были исключены, диагноз ЗНС был поставлен на основании симптомов мышечной ригидности, повышенной температуры и лейкоцитоза. После 10 недель госпитализации в отделение интенсивной терапии пациент был повторно госпитализирован в психиатрическое отделение. Его вес уменьшился до 41 кг (ИМТ = 12,2 кг/м 2 ). Во время повторной госпитализации он был взволнован и имел зрительные галлюцинации. Имеются экстрапирамидные симптомы. Нарушение психического статуса колебалось в течение дня с усилением возбуждения в ночное время. Был поставлен диагноз делирий. Вторично-генерализованные тонико-клонические судороги отмечались через день. Возбуждение лечили зипразидоном, а при судорогах вводили габапентин. За время последующей 6-месячной госпитализации состояние больного постепенно улучшилось, он прибавил в весе 12,5 кг (вес 53,5 кг, рост 1,83 м, ИМТ = 16,0 кг/м 9 ).0424 2 ). В июне 2010 г. выписан из стационара с диагнозом: шизофреноформное расстройство, осложненное злокачественным нейролептическим синдромом, по критериям DSM-IV TR. Он оставался под регулярным наблюдением в амбулаторной психиатрической клинике. Контрольные ЭЭГ, выполненные через 6 и 12 недель после описанного выше эпизода, были нормальными. Зипразидон и габапентин постепенно отменялись, других препаратов не требовалось.
Его вес уменьшился до 41 кг (ИМТ = 12,2 кг/м 2 ). Во время повторной госпитализации он был взволнован и имел зрительные галлюцинации. Имеются экстрапирамидные симптомы. Нарушение психического статуса колебалось в течение дня с усилением возбуждения в ночное время. Был поставлен диагноз делирий. Вторично-генерализованные тонико-клонические судороги отмечались через день. Возбуждение лечили зипразидоном, а при судорогах вводили габапентин. За время последующей 6-месячной госпитализации состояние больного постепенно улучшилось, он прибавил в весе 12,5 кг (вес 53,5 кг, рост 1,83 м, ИМТ = 16,0 кг/м 9 ).0424 2 ). В июне 2010 г. выписан из стационара с диагнозом: шизофреноформное расстройство, осложненное злокачественным нейролептическим синдромом, по критериям DSM-IV TR. Он оставался под регулярным наблюдением в амбулаторной психиатрической клинике. Контрольные ЭЭГ, выполненные через 6 и 12 недель после описанного выше эпизода, были нормальными. Зипразидон и габапентин постепенно отменялись, других препаратов не требовалось. В сентябре 2010 года он вернулся в школу. Однако из-за трудностей в обучении ему пришлось повторить занятия. После 2,5 лет амбулаторного наблюдения у него по-прежнему наблюдаются стойкие легкие нарушения памяти и концентрации внимания, а также эмоциональная лабильность. Других признаков психотических симптомов или судорог не было.
В сентябре 2010 года он вернулся в школу. Однако из-за трудностей в обучении ему пришлось повторить занятия. После 2,5 лет амбулаторного наблюдения у него по-прежнему наблюдаются стойкие легкие нарушения памяти и концентрации внимания, а также эмоциональная лабильность. Других признаков психотических симптомов или судорог не было.
Обсуждение
Это первое сообщение о педиатрическом пациенте с ЗНС и подтвержденным дефицитом CYP2D6. Симптомы, представленные пациентами, такие как лихорадка, ригидность, тахикардия, лейкоцитоз, потливость, аномальное кровяное давление, тахипноэ, измененный психический статус и повышенный уровень КФК, согласуются с клиническими проявлениями других пациентов с ЗНС [11]. Примечательно, что развитию НМС предшествовали такие кататонические симптомы, как мутизм, отказ от пищи и жидкости, снижение и чрезмерная двигательная активность. Имеются сообщения, предполагающие, что вызванная нейролептиками кататация может быть стадией, прогрессирующей до ЗНС [9]. ]. В представленном случае после введения нейтролептиков возникли кататонические симптомы, а дальнейшее лечение даже ухудшило психическое состояние больного (рис. 1).
]. В представленном случае после введения нейтролептиков возникли кататонические симптомы, а дальнейшее лечение даже ухудшило психическое состояние больного (рис. 1).
Этот случай иллюстрирует многофакторную причину ЗНС. Основными факторами риска являются вероятные непропорционально высокие концентрации лекарственного средства, которые, к сожалению, не были измерены, и токсичность, возникающая в результате многократного перорального и внутримышечного введения лекарств у пациентов с дисфункцией метаболических путей. Этот пациент получал повторные ежедневные дозы оланзапина. Ранее была описана роль оланзапина и его комбинации с левомепромазином в развитии ЗНС [5, 8]. Уровень оланзапина в плазме не должен превышать терапевтический уровень, так как он в основном метаболизируется CYP1A2 и в меньшей степени CYP2D6. Однако клиническая картина с отсутствием улучшения и седативного эффекта при адекватных дозах лекарств в сочетании с ухудшением кататонии предполагает токсичность препарата. Метаболизм левомепромазина и галоперидола катализируется CYP2D6, и их введение больным с недостаточной активностью этого фермента может вызывать побочные эффекты даже в стандартных дозах [3]. Кроме того, предполагается, что нефункциональные аллели CYP2D6 влияют на уязвимость к ЗНС в японской популяции [6]. Другие факторы, такие как обезвоживание, недоедание и тяжелая клиническая картина с возбуждением, также могут способствовать развитию ЗНС. Начальные симптомы у пациента также могут быть связаны со злоупотреблением препаратами, содержащими декстрометорфан и псевдоэпедрин, поскольку оба препарата метаболизируются CYP2D6 и, как известно, вызывают дистонию и психотические симптомы [10].
Метаболизм левомепромазина и галоперидола катализируется CYP2D6, и их введение больным с недостаточной активностью этого фермента может вызывать побочные эффекты даже в стандартных дозах [3]. Кроме того, предполагается, что нефункциональные аллели CYP2D6 влияют на уязвимость к ЗНС в японской популяции [6]. Другие факторы, такие как обезвоживание, недоедание и тяжелая клиническая картина с возбуждением, также могут способствовать развитию ЗНС. Начальные симптомы у пациента также могут быть связаны со злоупотреблением препаратами, содержащими декстрометорфан и псевдоэпедрин, поскольку оба препарата метаболизируются CYP2D6 и, как известно, вызывают дистонию и психотические симптомы [10].
В нашем отчете подчеркивается необходимость терапевтического лекарственного мониторинга (TDM) [4]. TDM экономически оправдан и может обнаруживать различные фармакокинетические проблемы, не ограничиваясь полиморфизмом CYP. К сожалению, в Польше ТЛМ нейролептиков не была внедрена в клиническую практику и, даже если она рекомендована, остается недоступной в психиатрических центрах. У описанного пациента было несколько показаний для измерения концентрации лекарства в плазме, таких как возможное начало симптомов, связанное с приемом лекарств, побочные эффекты при стандартных дозах лекарств, подозрение на нарушение метаболизма лекарств и подростковый возраст. Уровни препаратов в плазме, задействованных в этом случае, были бы полезны для оценки происхождения симптомов, изменения лечения и предотвращения драматических осложнений.
У описанного пациента было несколько показаний для измерения концентрации лекарства в плазме, таких как возможное начало симптомов, связанное с приемом лекарств, побочные эффекты при стандартных дозах лекарств, подозрение на нарушение метаболизма лекарств и подростковый возраст. Уровни препаратов в плазме, задействованных в этом случае, были бы полезны для оценки происхождения симптомов, изменения лечения и предотвращения драматических осложнений.
Сокращения
- НОМЕР:
Азот мочевины крови
- КПК:
Креатининфосфокиназа сыворотки
- DSM-IV TR:
Диагностическое и статистическое руководство по психическим расстройствам, четвертое издание, редакция текста
- ЭЭГ:
Электроэнцефалография
- ОИТ:
Отделение интенсивной терапии
- НМС:
Злокачественный нейролептический синдром
- ПКР:
Полимеразная цепная реакция
- SCC:
Креатинин
- TDM:
Лекарственный мониторинг
- WBC:
Количество лейкоцитов
Ссылки
- ">
Croarkin PE, Emslie GJ, Mayes TL (2008)Злокачественный нейролептический синдром, связанный с атипичными нейролептиками у детей: обзор опубликованных случаев. J Clin Psychiatry 69(7):1157–1165
Статья КАС пабмед Google Scholar
Fang J, Baker GB, Silverstone PH, Coutts RT (1997) Участие CYP3A4 и CYP2D6 в метаболизме галоперидола. Cell Mol Neurobiol 17(2):227–233
Артикул КАС пабмед Google Scholar
Химке С., Бауманн П., Бергеманн Н., Конка А., Дитмайер О., Эгбертс К., Фрик М., Герлах М.
 , Грайнер С., Грундер Г., Хаен Э., Хавенман-Райнеке У., Жакено Сиро Э., Кирхерр Х., Лаукс G, Lutz UC, Messer T, Muller MJ, Pfuhlmann B, Rambeck B, Riederer P, Schoppek B, Stingl J, Uhr M, Ulrich S, Waschgler R, Zernig G (2011) Консенсусные рекомендации AGNP по терапевтическому лекарственному мониторингу в психиатрии: обновление 2011 г. Фармакопсихиатрия 44(6):195–235. дои: 10.1055/s-0031-1286287
, Грайнер С., Грундер Г., Хаен Э., Хавенман-Райнеке У., Жакено Сиро Э., Кирхерр Х., Лаукс G, Lutz UC, Messer T, Muller MJ, Pfuhlmann B, Rambeck B, Riederer P, Schoppek B, Stingl J, Uhr M, Ulrich S, Waschgler R, Zernig G (2011) Консенсусные рекомендации AGNP по терапевтическому лекарственному мониторингу в психиатрии: обновление 2011 г. Фармакопсихиатрия 44(6):195–235. дои: 10.1055/s-0031-1286287Артикул Google Scholar
Jarventausta K, Leinonen E (2000) Злокачественный нейролептический синдром при лечении оланзапином и левомепромазином. Acta Psychiatr Scand 102(3):231–233
Статья КАС пабмед Google Scholar
Kato D, Kawanishi C, Kishida I, Furuno T, Suzuki K, Onishi H, Hirayasu Y (2007) Влияние полиморфизмов CYP2D6 на злокачественный нейролептический синдром. Евр Дж Клин Фармакол 63(11):991–996.
 дои: 10.1007/s00228-007-0355-8
дои: 10.1007/s00228-007-0355-8Артикул КАС пабмед Google Scholar
Kishida I, Kawanishi C, Furuno T, Kato D, Ishigami T, Kosaka K (2004) Ассоциация у японских пациентов между нейролептическим злокачественным синдромом и функциональным полиморфизмом гена рецептора допамина D(2). Мол психиатрия 9 (3): 293-298. doi:10.1038/sj.mp.4001422
Артикул КАС пабмед Google Scholar
Kontaxakis VP, Havaki-Kontaxaki BJ, Christodoulou NG, Paplos KG (2002)Оланзапин-ассоциированный злокачественный нейролептический синдром. Prog Neuropsychopharmacol Biol Psychiatry 26(5):897–902
Статья КАС пабмед Google Scholar
Лучини Ф., Латтанци Л., Бартоломей Н., Косентино Л., Литта А., Кански С., Маури М.
 , Кассано Г.Б., Фаджолини А., Касамассима Ф. (2013) Кататония и злокачественный нейролептический синдром: два расстройства одного спектра? Отчеты о четырех случаях. J Nerv Ment Dis 201 (1): 36–42. Дои: 10.1097/NMD.0b013e31827ab24b
, Кассано Г.Б., Фаджолини А., Касамассима Ф. (2013) Кататония и злокачественный нейролептический синдром: два расстройства одного спектра? Отчеты о четырех случаях. J Nerv Ment Dis 201 (1): 36–42. Дои: 10.1097/NMD.0b013e31827ab24bАртикул пабмед Google Scholar
Soutullo CA, Cottingham EM, Keck PE Jr (1999) Психоз, связанный с псевдоэфедрином и декстрометорфаном. J Am Acad Child Adolesc Psychiatry 38 (12): 1471–1472. дои: 10.1097/00004583-199912000-00004
Артикул КАС пабмед Google Scholar
van Maidegem BT, Smit LME, Touw DJ, Gemke RJBJ (2002) Злокачественный нейролептический синдром у 4-летней девочки, связанный с алимемазином. Европейское педиатрическое издание 161(5):259–261. дои: 10.1007/s00431-002-0956-2
Артикул Google Scholar
Clavenna A, Rossi E, DeRosa M, Bonati M (2007) Использование психотропных препаратов у итальянских детей и подростков. Евр. Дж. Педиатр 166 (4): 339–347. дои: 10.1007/s00431-006-0244-7
Артикул пабмед Google Scholar
Скачать ссылки
Благодарности
Мы благодарим доктора Самира Джаухара из Института психиатрии Королевского колледжа Лондона за его конструктивные комментарии и корректуру.
Конфликт интересов
Мы сообщаем об отсутствии конфликта интересов.
Информация об авторе
Авторы и организации
Кафедра медицинской эпидемиологии и биостатистики Каролинского института, а/я 281, 171 77, Стокгольм, Швеция
Агнешка Бутвицка
Кафедра детской психиатрии, Варшавский медицинский университет, 2 ул. Маршалковская, 4, 00-575 , Варшава, Польша
Агнешка Бутвицка, Шиманская Кристина и Томаш Воланчик
Отделение детской анестезии Варшавского медицинского университета, Варшава, Польша
Влодзимеж Ретка
- Agnieszka Butwicka
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Szymańska Krystyna
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Włodzimierz Retka
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Академия
- Tomasz Wolańczyk
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Автор, ответственный за корреспонденцию
Агнешка Бутвицкая.
 В. «Идеальный антипсихотик» для лечения шизофрении: реальность или/и иллюзии. — Санкт-Петербург, 27.10.2011. — С. 18. — 30 с.
В. «Идеальный антипсихотик» для лечения шизофрении: реальность или/и иллюзии. — Санкт-Петербург, 27.10.2011. — С. 18. — 30 с. В. «Идеальный антипсихотик» для лечения шизофрении: реальность или/и иллюзии. — Санкт-Петербург, 27.10.2011. — С. 18. — 30 с.
В. «Идеальный антипсихотик» для лечения шизофрении: реальность или/и иллюзии. — Санкт-Петербург, 27.10.2011. — С. 18. — 30 с.

 ст. в течение 24 часов)
ст. в течение 24 часов) , Грайнер С., Грундер Г., Хаен Э., Хавенман-Райнеке У., Жакено Сиро Э., Кирхерр Х., Лаукс G, Lutz UC, Messer T, Muller MJ, Pfuhlmann B, Rambeck B, Riederer P, Schoppek B, Stingl J, Uhr M, Ulrich S, Waschgler R, Zernig G (2011) Консенсусные рекомендации AGNP по терапевтическому лекарственному мониторингу в психиатрии: обновление 2011 г. Фармакопсихиатрия 44(6):195–235. дои: 10.1055/s-0031-1286287
, Грайнер С., Грундер Г., Хаен Э., Хавенман-Райнеке У., Жакено Сиро Э., Кирхерр Х., Лаукс G, Lutz UC, Messer T, Muller MJ, Pfuhlmann B, Rambeck B, Riederer P, Schoppek B, Stingl J, Uhr M, Ulrich S, Waschgler R, Zernig G (2011) Консенсусные рекомендации AGNP по терапевтическому лекарственному мониторингу в психиатрии: обновление 2011 г. Фармакопсихиатрия 44(6):195–235. дои: 10.1055/s-0031-1286287 дои: 10.1007/s00228-007-0355-8
дои: 10.1007/s00228-007-0355-8 , Кассано Г.Б., Фаджолини А., Касамассима Ф. (2013) Кататония и злокачественный нейролептический синдром: два расстройства одного спектра? Отчеты о четырех случаях. J Nerv Ment Dis 201 (1): 36–42. Дои: 10.1097/NMD.0b013e31827ab24b
, Кассано Г.Б., Фаджолини А., Касамассима Ф. (2013) Кататония и злокачественный нейролептический синдром: два расстройства одного спектра? Отчеты о четырех случаях. J Nerv Ment Dis 201 (1): 36–42. Дои: 10.1097/NMD.0b013e31827ab24b