Анестезия при хирургическом лечении у больных церебральным параличом (обзор)
Детский церебральный паралич (ДЦП) — одна из основных причин детской инвалидности в развитых странах. Современная тактика помощи детям с ДЦП объединяет лечение в больнице и адаптацию в обществе. Цель его состоит в том, чтобы создать для детей-инвалидов возможность реабилитации, в том числе и с помощью хирургических вмешательств. Спектр хирургических вмешательств при этом достаточно широк: от общехирургических вмешательств до специфических операций по поводу ДЦП.
Специфические оперативные вмешательства охватывают нейрохирургические операции для снижения мышечной спастичности (высокоселективная дорсальная ризотомия или имплантация нейростимулятора) и разнообразные пластические ортопедические операции на мягких или костных тканях конечностей и позвоночника.
Обезболивание и жизнеобеспечение ребенку во время операции осуществляет анестезиолог. Анестезирующие средства и анальгетики, которые используются для защиты больного от операционного стресса, воздействуют на те же структуры ЦНС, повреждение которых является причиной ДЦП.
Ребенок с ДЦП принципиально отличается от пациентов любого другого профиля наличием тяжелой сопутствующей патологии.
При этом значительное количество сопутствующих расстройств так или иначе связаны с церебральным параличом. Кроме того, дети с ДЦП часто имеют тяжелые зрительные (слепота различной степени) и слуховые (тугоухость) нарушения. Это совместно с проблемами коммуникации и интеллектуальным дефицитом ведет к сложностям в общении медицинского персонала с больным.
Остановимся на отдельных группах сопутствующих нарушений.
Нервная система. Около 30% детей с ДЦП страдают эпилепсией и получают перманентное лечение. Есть данные, что антиконвульсант вальпроат натрия может усиливать кровотечение из-за дисфункции тромбоцитов, тромбоцитопении или дефицита фактора Виллебранда первого типа. Этот дозозависимый эффект возникает обычно при уровне вальпроата в сыворотке более 100 мг/мл 3. Сокращение дозы или (редко) прекращение приема вальпроата натрия нормализует показатели коагуляции [7], что необходимо отслеживать и учитывать анестезиологу, прогнозируя объем кровопотери.
Сокращение дозы или (редко) прекращение приема вальпроата натрия нормализует показатели коагуляции [7], что необходимо отслеживать и учитывать анестезиологу, прогнозируя объем кровопотери.
Антропометрические особенности. Исследования показали, что дети с ДЦП неэффективно используют энергию, получаемую с пищей, и не могут восполнить увеличенные энергетические затраты. Это приводит к уменьшению роста в сравнении со здоровыми сверстниками [11, 28]. У пациентов с ДЦП имеется также предрасположенность к остеопорозу. Указанные особенности связаны также со сниженной экспоненцией солнечного света, неподвижностью, мышечной спастичностью и метаболическим преобразованием предшественников витамина D в неактивные метаболиты (часто из-за противосудорожного лечения) [24].
Дыхательная система. Пациенты с тетрапарезом имеют повышенный риск аспирации [18, 27]. Аспирация может быть результатом дисфункции глотания и изменения желудочной секреции, вызывающей пищеводный рефлюкс [22].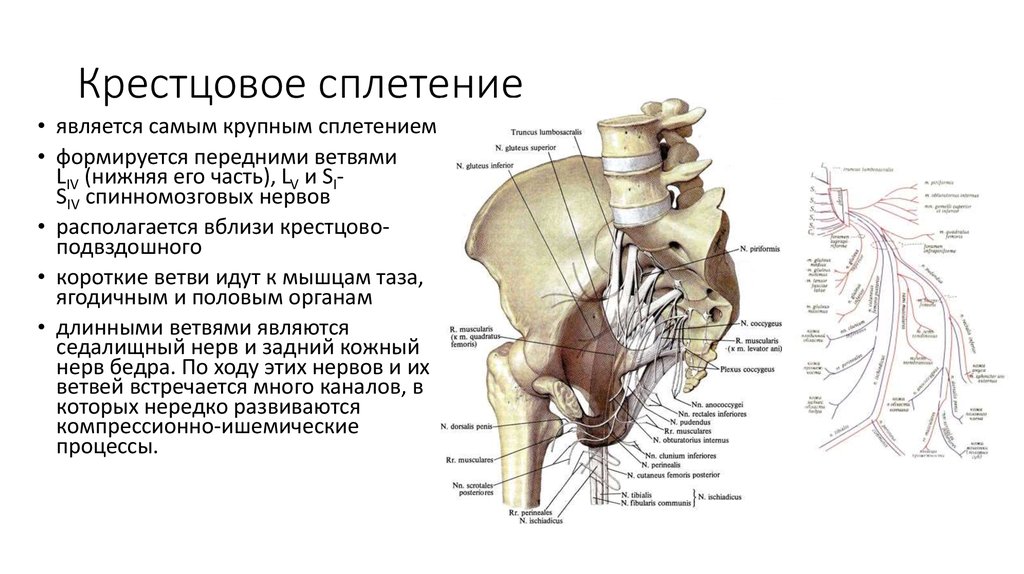 Также отмечается склонность к ларингоспазму на фоне увеличенной секреции и саливации. Хронические респираторные инфекции и наличие сколиоза неблагоприятно влияют на вентиляцию легких, вызывая обструктивные и рестриктивные расстройства на этапе выхода больного из общей анестезии.
Также отмечается склонность к ларингоспазму на фоне увеличенной секреции и саливации. Хронические респираторные инфекции и наличие сколиоза неблагоприятно влияют на вентиляцию легких, вызывая обструктивные и рестриктивные расстройства на этапе выхода больного из общей анестезии.
Желудочно-кишечная система. Главные проблемы — рвота и запор. Рвота — часто результат гастроэзофагального рефлюкса и эзофагита [13, 25]. Гастроэзофагальный рефлюкс прогрессирует после пубертатного периода [21]. Патология полости рта (кариес, гипоплазия эмали, аномалии прикуса), наличие хронической гиподинамии и нарушений нутритивного статуса ведут к глубоким электролитным нарушениям и анемии. Эти нарушения также способствуют увеличению количества пневмоний в послеоперационном периоде.
Сердечно-сосудистая система. Пациентам с ДЦП в связи со спастическим синдромом свойственны показатели центральной гемодинамики, отличающиеся от таковых у здоровых детей [3, 5]. Для этой категории больных характерны слабое вегетативное обеспечение и низкие адаптационно-компенсаторные возможности системы кровообращения при стрессовой ситуации. Поэтому для них характерны постуральные реакции на фоне анестезии, склонность к артериальной гипотензии и тахикардии во время операции. Необходимо также отметить, что у больных ДЦП имеются оказывающие на функцию сердечно-сосудистой системы вегегативные нарушения. Ваготонический тип вегетативной реактивности в основном присущ детям старшего возраста, в то время как для детей младшего и среднего возраста характерна симпатико-тоническая реактивность [6]. Отмеченные выше изменения центральной гемодинамики у больных ДЦП с поражением опорно-двигательного аппарата зависят от степени снижения возможности ребенка к самостоятельному передвижению, а самые значительные изменения ударного и минутного объемов кровообращения в период общей анестезии и операции выявляются у больных, утративших способность к самостоятельному передвижению [6].
Поэтому для них характерны постуральные реакции на фоне анестезии, склонность к артериальной гипотензии и тахикардии во время операции. Необходимо также отметить, что у больных ДЦП имеются оказывающие на функцию сердечно-сосудистой системы вегегативные нарушения. Ваготонический тип вегетативной реактивности в основном присущ детям старшего возраста, в то время как для детей младшего и среднего возраста характерна симпатико-тоническая реактивность [6]. Отмеченные выше изменения центральной гемодинамики у больных ДЦП с поражением опорно-двигательного аппарата зависят от степени снижения возможности ребенка к самостоятельному передвижению, а самые значительные изменения ударного и минутного объемов кровообращения в период общей анестезии и операции выявляются у больных, утративших способность к самостоятельному передвижению [6].
Выявлена высокая летальность взрослых с церебральным параличом от ишемической болезни сердца [31].
Подводя итог обзору соматических особенностей детей с ДЦП можно утверждать, что такие пациенты, еще не став объектом хирургического вмешательства, уже представляют проблему для анестезиолога. Причем при взрослении таких больных количество сопутствующей патологии только увеличивается, усугубляя риск анестезии. Но основная особенность пациентов с ДЦП — это, конечно же, выраженная в той или иной степени мышечная спастичность. Лечение спастичности мышц продолжается у таких пациентов на протяжении всей жизни. При планировании анестезии необходимо учитывать, что анестетики могут усилить эффект антиспастических средств, особенно центрально действующих медикаментов.
Причем при взрослении таких больных количество сопутствующей патологии только увеличивается, усугубляя риск анестезии. Но основная особенность пациентов с ДЦП — это, конечно же, выраженная в той или иной степени мышечная спастичность. Лечение спастичности мышц продолжается у таких пациентов на протяжении всей жизни. При планировании анестезии необходимо учитывать, что анестетики могут усилить эффект антиспастических средств, особенно центрально действующих медикаментов.
Исходя из вышеизложенного, перед анестезиологами встает довольно трудная задача выбора методики анестезиологического пособия и способов профилактики возможных осложнений на каждом из этапов анестезии.
Дооперационная оценка состояния ребенка. Коммуникационные и социальные проблемы часто усложняют дооперационную оценку детей с ДЦП [34]. Нередко дети подвергаются повторным процедурам, следовательно, подвержены воздействию предыдущего опыта и опасаются людей в белых халатах. Дети с ДЦП из-за многократных хирургических процедур подвергаются также воздействию латексных аллергенов с раннего возраста, что проявляется увеличенным риском развития латексной аллергии [23].
Премедикация. При назначении премедикации больным ДЦП необходимо соблюдение двух принципиальных моментов.
Во-первых, премедикация должна обязательно включать бензодиазепины. Это продиктовано тем, что большинство детей с ДЦП негативно воспринимают любые медицинские манипуляции и могут быть аффективны. Также надо учитывать, что в случае, когда пациент с ДЦП имеет длительный стаж приема антиспастических и антиконвульсивных препаратов, разумным шагом будет увеличение дозы бензодиазепинов для премедикации, так как у таких пациентов возможно развитие толерантности к седативным препаратам.
Во-вторых, часто у детей, страдающих ДЦП, отмечается гиперсаливация из-за уменьшенной способности глотать слюну на фоне увеличенной секреции, что диктует назначение в премедикацию холиноблокаторов. Идеальный препарат для уменьшения саливации у пациентов с ДЦП — это гликопирролат, синтетический аналог атропина, который является самым мощным ингибитором секреции слюнных желез. Он практически не оказывает влияния на ЦНС и не вызывает тахикардии, но разрешен, к сожалению, только в ветеринарии. Поэтому самым распространенным препаратом для премедикации, несмотря на ряд побочных эффектов, остается атропин. У детей, страдающих ДЦП, атропин может увеличить риск респираторной инфекции за счет уменьшения легочной секреции, вызвать психомоторное возбуждение и тахикардию.
Идеальный препарат для уменьшения саливации у пациентов с ДЦП — это гликопирролат, синтетический аналог атропина, который является самым мощным ингибитором секреции слюнных желез. Он практически не оказывает влияния на ЦНС и не вызывает тахикардии, но разрешен, к сожалению, только в ветеринарии. Поэтому самым распространенным препаратом для премедикации, несмотря на ряд побочных эффектов, остается атропин. У детей, страдающих ДЦП, атропин может увеличить риск респираторной инфекции за счет уменьшения легочной секреции, вызвать психомоторное возбуждение и тахикардию.
Индукция и поддержание анестезии. Для проведения анестезии можно использовать любые препараты, кроме этомидата, кетамина и энфлюрана, так как они могут провоцировать судороги у пациентов с наличием эпилептической активности на ЭЭГ [34]. Оптимальным выбором для внутривенной индукции являются препараты барбитуровой кислоты или пропофол.
Мониторинг биспектрального индекса (BIS) на ЭЭГ был первым методом, введенным в клиническую практику для измерения глубины седативного эффекта. Естественно, что многих исследователей заинтересовало, нуждаются ли дети с ДЦП и с задержкой умственного развития в более низкой дозировке пропофола для индукции, используя для решения этого вопроса критерии BIS-мониторинга. Полученные данные предполагают, что дети с ДЦП и интеллектуальным дефицитом требуют меньших доз пропофола для индукции анестезии, чем здоровые дети для достижения тех же самых значений BIS (т.е. 35-45) [30]. Известно, что пациенты с церебральным параличом более чувствительны к общим анестетикам, что может оказать неблагоприятное влияние на этапе пробуждения от анестезии [14].
Естественно, что многих исследователей заинтересовало, нуждаются ли дети с ДЦП и с задержкой умственного развития в более низкой дозировке пропофола для индукции, используя для решения этого вопроса критерии BIS-мониторинга. Полученные данные предполагают, что дети с ДЦП и интеллектуальным дефицитом требуют меньших доз пропофола для индукции анестезии, чем здоровые дети для достижения тех же самых значений BIS (т.е. 35-45) [30]. Известно, что пациенты с церебральным параличом более чувствительны к общим анестетикам, что может оказать неблагоприятное влияние на этапе пробуждения от анестезии [14].
Цель одного из исследований [33] состояла в том, чтобы оценить восстановление сознания пациентов с ДЦП по сравнению с больными без заболеваний ЦНС. Всем детям проводилась комбинированная анестезия севораном, закисью азота с эпидуральным введением наропина для исключения влияния ноцицептивной стимуляции на показатели BIS-мониторинга. Результаты говорят о том, что больные ДЦП более медленно возвращаются к сознательному состоянию (в среднем на 15-30 мин дольше) по сравнению с пациентами без патологии ЦНС.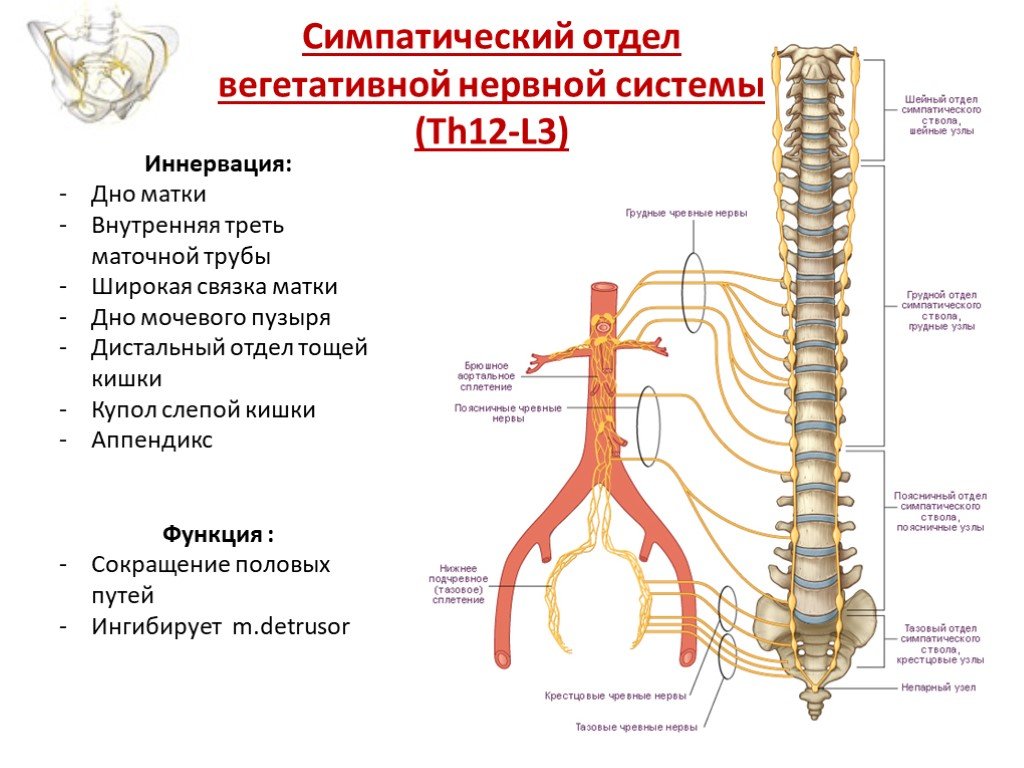 Авторы объясняют эту разницу более низкой минимальной альвеолярной концентрацией (МАК) ингаляционных анестетиков у больных ДЦП и наличием мозгового поражения с нарушением мозгового кровотока. В то же время, исследователи подвергли сомнению влияние антиконвульсантов на динамику показателей BIS.
Авторы объясняют эту разницу более низкой минимальной альвеолярной концентрацией (МАК) ингаляционных анестетиков у больных ДЦП и наличием мозгового поражения с нарушением мозгового кровотока. В то же время, исследователи подвергли сомнению влияние антиконвульсантов на динамику показателей BIS.
Имеется определенная специфика у детей с ДЦП относительно переносимости ингаляционных анестетиков. MAK для галотана была измерена у детей со спастическими состояниями в возрасте от 4 до 18 лет во время анестезии при ортопедических операциях и оказалась на 20% ниже у детей с ДЦП и на 10% ниже у пациентов, которые на тот момент принимали антиконвульсанты [19]. Анестезия ингаляцией севорана под контролем BIS-мониторинга должна рассматриваться как оптимальный выбор для детей с ДЦП.
Исследования мышечных релаксантов указывают на чувствительность к сукцинилхолину у детей с ДЦП по сравнению с пациентами без патологии ЦНС. При исследовании ответа на однократное введение сукцинилхолина в условиях анестезии пропофолом и закисью азота ряд авторов [10, 32] отметили несколько сниженный ED50 и ED95 по сравнению с контрольной группой. В сравнительном исследовании D. Moorthy и соавт. [27] показали толерантность к векуронию у детей с ДЦП. Время от введения 0,1 мг/кг к 25% восстановлению ответа скелетных мышц у детей с ДЦП было меньше, чем у здоровых детей. Механизм устойчивости к векуронию — взаимодействие препарата с антиконвульсантами, увеличенный печеночный клиренс, дизрегулирование рецепторов ацетилхолина. Следовательно, дозы недеполяризующих стероидных миорелаксантов у пациентов с ДЦП могут быть увеличены.
В сравнительном исследовании D. Moorthy и соавт. [27] показали толерантность к векуронию у детей с ДЦП. Время от введения 0,1 мг/кг к 25% восстановлению ответа скелетных мышц у детей с ДЦП было меньше, чем у здоровых детей. Механизм устойчивости к векуронию — взаимодействие препарата с антиконвульсантами, увеличенный печеночный клиренс, дизрегулирование рецепторов ацетилхолина. Следовательно, дозы недеполяризующих стероидных миорелаксантов у пациентов с ДЦП могут быть увеличены.
Методы поддержания проходимости дыхательных путей. Данных относительно сравнительной оценки методов поддержания проходимости дыхательных путей в этой специфической группе пациентов опубликовано мало. Ряд анестезиологов для проведения интраоперационной искусственной вентиляции легких (ИВЛ) выбирают ларингеальную маску [4, 26] с установкой назогастрального дренажа для аспирации желудочного содержимого. Другие останавливают свой выбор на эндотрахеальной трубке, которая позволяет надежно изолировать дыхательные пути от содержимого желудочно-кишечного тракта и дает возможность проводить операции любой продолжительности и при любом положении ребенка на операционном столе.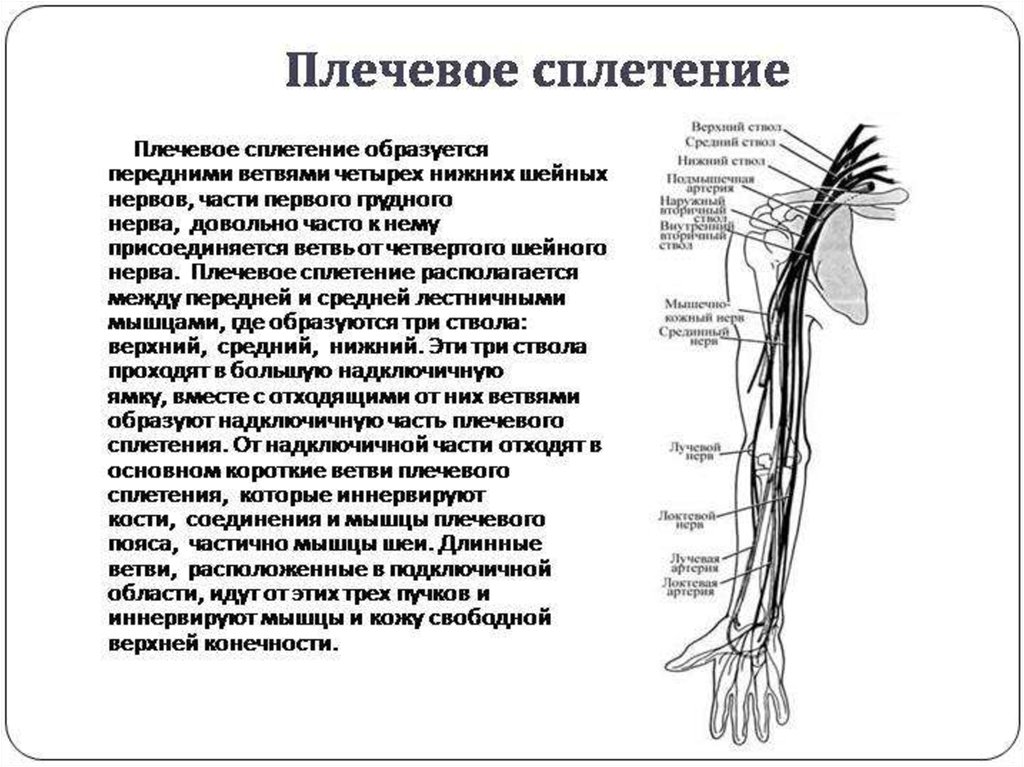 Однако надо иметь в виду, что экстубация пациентов с ДЦП всегда протекает на фоне «парасимпатической бури», гиперсаливации и усиления спастичности всей мускулатуры. Это неизбежно ведет к частому, около 6% случаев, развитию ларингоспазма, который даже при своевременной терапии у 0,5% пациентов переходит в тотальный бронхоспазм. Углубление седации и атропинизация во время удаления эндотрахеальной трубки позволяют решить ряд проблем, но могут вызвать у этой категории пациентов чрезмерное напряжение сердечно-сосудистой системы, угнетение дыхания и развитие гипоксии.
Однако надо иметь в виду, что экстубация пациентов с ДЦП всегда протекает на фоне «парасимпатической бури», гиперсаливации и усиления спастичности всей мускулатуры. Это неизбежно ведет к частому, около 6% случаев, развитию ларингоспазма, который даже при своевременной терапии у 0,5% пациентов переходит в тотальный бронхоспазм. Углубление седации и атропинизация во время удаления эндотрахеальной трубки позволяют решить ряд проблем, но могут вызвать у этой категории пациентов чрезмерное напряжение сердечно-сосудистой системы, угнетение дыхания и развитие гипоксии.
У детей с ДЦП, если нет необходимости в prone position, проведении ИВЛ, и длительность операции не превышает 2 ч, оптимальным выбором анестезиологического пособия являются различные виды регионарной анестезии на фоне седации (показатели BIS — 65-55) с сохранением спонтанного дыхания.
Инфузионная терапия. Пациенты с ДЦП, которые в результате спастичности мышц частично или полностью лишены способности к самостоятельному передвижению, естественно, гиподинамичны. Это в свою очередь приводит к уменьшению объема циркулирующей крови (ОЦК) и постуральным реакциям кровообращения. Уменьшению ОЦК способствует и предоперационное ограничение жидкости, которое у этой группы пациентов более продолжительное. Также необходимо учитывать, что система кровообращения у пациентов с ДЦП функционирует с повышенной производительностью и характеризуется парадоксальной реакцией на нагрузку [3, 31]. Основная «гемодинамическая» проблема у пациентов с ДЦП — это исходная гиповолемия, которая усугубляется действием анестетиков, эпидуральной блокадой, постуральными реакциями. Поэтому инфузионная терапия должна быть довольно агрессивной и включать в себя коррекцию хронического дефицита ОЦК, восполнение дефицита жидкости, возникающего в результате предоперационного голодания, компенсацию интраоперационных потерь жидкости, а также дефицита объема жидкости в результате увеличения емкостных сосудов.
Это в свою очередь приводит к уменьшению объема циркулирующей крови (ОЦК) и постуральным реакциям кровообращения. Уменьшению ОЦК способствует и предоперационное ограничение жидкости, которое у этой группы пациентов более продолжительное. Также необходимо учитывать, что система кровообращения у пациентов с ДЦП функционирует с повышенной производительностью и характеризуется парадоксальной реакцией на нагрузку [3, 31]. Основная «гемодинамическая» проблема у пациентов с ДЦП — это исходная гиповолемия, которая усугубляется действием анестетиков, эпидуральной блокадой, постуральными реакциями. Поэтому инфузионная терапия должна быть довольно агрессивной и включать в себя коррекцию хронического дефицита ОЦК, восполнение дефицита жидкости, возникающего в результате предоперационного голодания, компенсацию интраоперационных потерь жидкости, а также дефицита объема жидкости в результате увеличения емкостных сосудов.
Интраоперационная гипотермия. Дети с ДЦП быстро теряют тепло, например при постановке эпидурального катетера. Дальнейшая экспозиция в прохладной операционной во время операции и последующие изменения положения больного при многоуровневой ортопедической операции на мягких тканях, этап гипсования приводят к увеличению потери тепла [34]. Укладка пациентов с контрактурами может быть проблематичной, часто не позволяющей использовать поддержку конструкциями обычных операционных столов. Пролежневые раны и повреждение нервов от сдавления во время длительных операций — это также реальная опасность [28].
Дальнейшая экспозиция в прохладной операционной во время операции и последующие изменения положения больного при многоуровневой ортопедической операции на мягких тканях, этап гипсования приводят к увеличению потери тепла [34]. Укладка пациентов с контрактурами может быть проблематичной, часто не позволяющей использовать поддержку конструкциями обычных операционных столов. Пролежневые раны и повреждение нервов от сдавления во время длительных операций — это также реальная опасность [28].
Эпидуральная блокада. Большинство основных хирургических вмешательств у детей с ДЦП проводится под общей анестезией в сочетании с регионарным обезболиванием [1, 2, 28].
Непрерывное послеоперационное эпидуральное введение 0,1% раствора бупивакаина и фентанила 2 мкг/кг, как считают B. Brenn и соавт. [12], обеспечивает лучшее обезболивание с немногими побочными эффектами. Доказательством необходимости использования эпидуральной анестезии у пациентов с ДЦП служит обширное рандомизированное исследование [29], в котором сравнивалась эффективность послеоперационного обезболивания в 4 группах пациентов.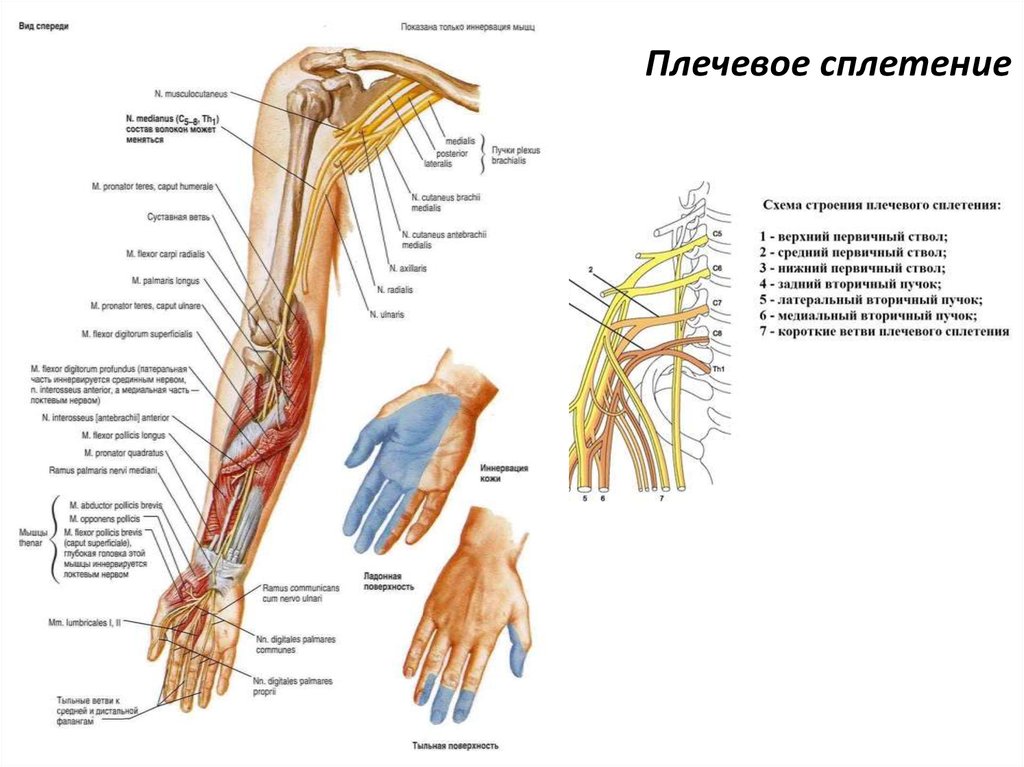 Одна группа больных была оперирована под общей анестезией, в трех других в дополнение к ингаляционной анестезии эпидурально каудальным доступом вводились морфин 40 мкг/кг, бупренорфин 3 мкг/кг и буторфанол 30 мкг/кг. Пациенты, которые получили анальгетики более 2 раз в течение 24 ч после операции, были только в группе общей анестезии. Введенные эпидурально опиоиды не увеличивали частоту побочных эффектов в виде тошноты, рвоты, зуда и др. Инциденты уменьшения частоты и глубины дыхания, гипоксемии, задержки мочи не зависели от типа ДЦП или анестезии. Не было разницы в седативном эффекте между пациентами со спастической диплегией и тетраплегией. Также не было никакой разницы в степени седативного эффекта среди групп с каудальной анестезией. Авторы заключают, что эпидурально введенные опиоиды позволяют достигнуть безопасного и адекватного послеоперационного контроля боли у детей с ДЦП.
Одна группа больных была оперирована под общей анестезией, в трех других в дополнение к ингаляционной анестезии эпидурально каудальным доступом вводились морфин 40 мкг/кг, бупренорфин 3 мкг/кг и буторфанол 30 мкг/кг. Пациенты, которые получили анальгетики более 2 раз в течение 24 ч после операции, были только в группе общей анестезии. Введенные эпидурально опиоиды не увеличивали частоту побочных эффектов в виде тошноты, рвоты, зуда и др. Инциденты уменьшения частоты и глубины дыхания, гипоксемии, задержки мочи не зависели от типа ДЦП или анестезии. Не было разницы в седативном эффекте между пациентами со спастической диплегией и тетраплегией. Также не было никакой разницы в степени седативного эффекта среди групп с каудальной анестезией. Авторы заключают, что эпидурально введенные опиоиды позволяют достигнуть безопасного и адекватного послеоперационного контроля боли у детей с ДЦП.
В лечении послеоперационной боли после селективной ризотомии в поясничной области эпидуральная аналгезия морфином остается методом выбора [8].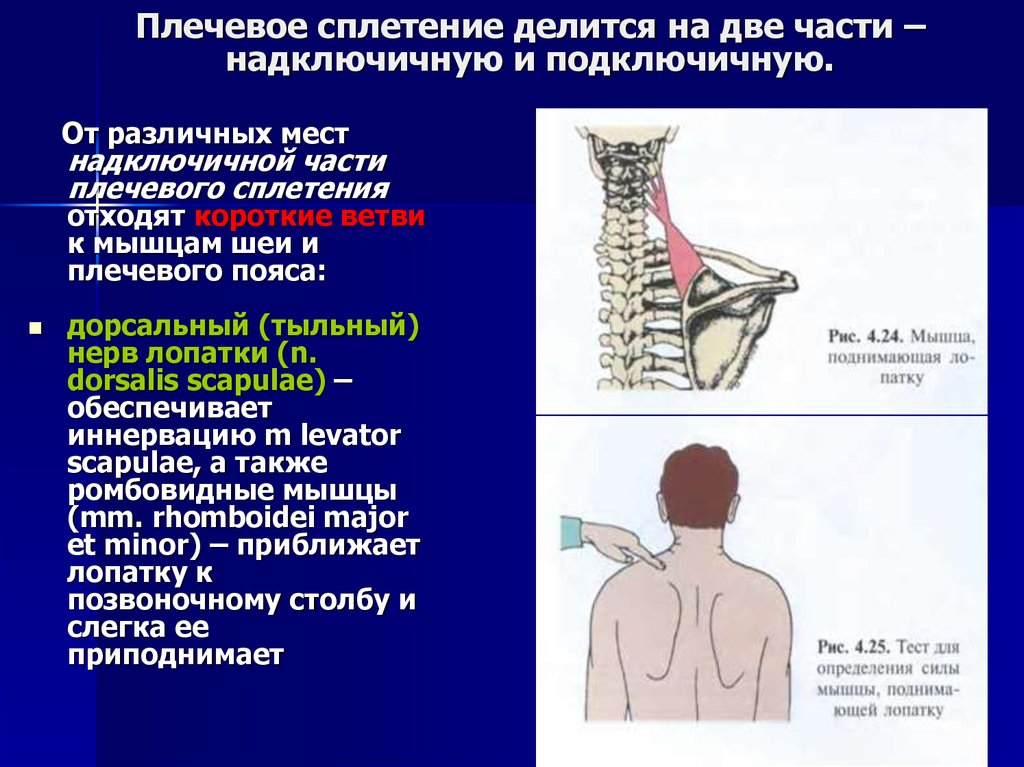
Периферическая регионарная блокада. Широкое применение высокой регионарной периферической анестезии у детей, страдающих ДЦП, подняло уровень анестезиологической помощи таким пациентам. Появилась возможность при операции на одной конечности обеспечить аналгезию и миорелаксацию только в зоне операции на фоне введения гипнотика, не прибегая к использованию центральных анальгетиков и миорелаксантов. Стало допустимым проведение довольно длительного анестезиологического пособия в условиях спонтанного дыхания пациента (на фоне седации современными гипнотиками), которое более физиологично, чем ИВЛ.
Метод регионарных блоков особенно полезен в прогнозировании нового функционального баланса мышц и моделирования лечения [17]. Данное утверждение поддерживают многие исследователи, показывая, что различные варианты моторных блоков уменьшают спастичность мышц и связанную с ней боль, улучшая походку и проведение гигиенических процедур пациентам. В то же время регионарная анестезия позволяет прогнозировать эффекты операций, давая возможность оценить ожидаемый результат хирургического лечения, не используя скальпель [15, 34].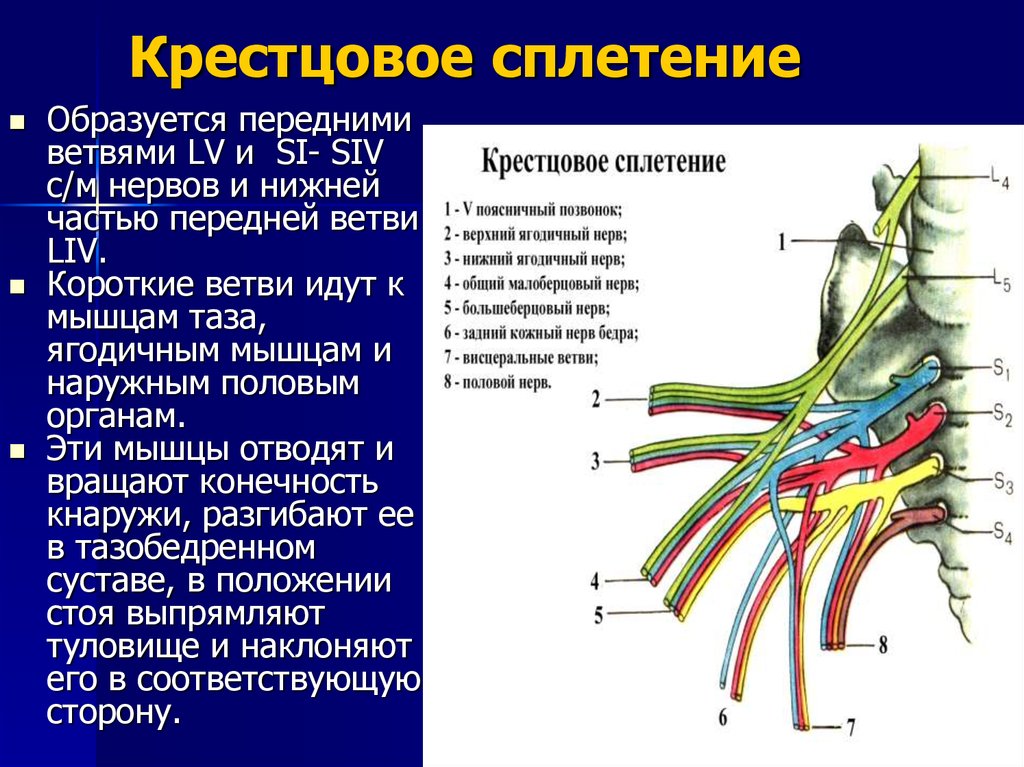
Послеоперационное обезболивание. Боль той или иной степени выраженности сопровождает больных ДЦП на протяжении всей жизни. Она возникает как вследствие неврологического дефицита, связанного с болезнью, так и в результате агрессивных хирургических процедур и реабилитирующих мероприятий, которым дети с ДЦП подвергаются достаточно регулярно.
Результаты проведенных исследований на тему распространенности боли средней и сильной степени выраженности в популяции пациентов с ДЦП поражают. Современные данные литературы свидетельствуют, что боль — это рутинный опыт для детей с ДЦП. По данным разных авторов [9, 16], боли испытывают от 67 до 84% больных ДЦП. При этом вмешательства, часто используемые, чтобы улучшить двигательную функцию, изменить деформации, уменьшить боль и улучшить качество жизни, могут фактически вызывать боль или дискомфорт впоследствии, по крайней мере временно [20, 28].
Поэтому лечение боли после операции также является функцией анестезиолога.
Роль регионарных блокад в диагностике, лечении и реабилитации больных ДЦП. До недавнего времени к регионарной анестезии относились только как к компоненту анестезиологического пособия. Современные реалии регионарной анестезии — это возможность использования регионарных блокад для лечения спастики и боли, а также как диагностического мероприятия. Регионарная анестезия у больных ДЦП не только обеспечивает адекватное обезболивание во время оперативного вмешательства, но и существенно улучшает течение послеоперационного периода за счет длительной аналгезии и снижения спастичности мышц в оперированной конечности.
Регионарная анестезия дает возможность: проводить лечебные блокады, которые позволяют дифференцировать контрактуры суставов от функциональных установок; обеспечить поэтапное наложение гипсовых повязок в условиях миорелаксации и аналгезии; оптимизировать ЛФК-процедуры; уменьшить спастичность мышц и хронический болевой синдром; прогнозировать эффекты ботулинотерапии.
Преимущество регионарных блокад — это обратимый эффект, короткий по продолжительности. Это относительно безболезненная манипуляция, которая в течение короткого времени (20-30 мин) позволяет дифференцировать контрактуру от мышечной спастичности, позволяет выявить активность в мышцах-антагонистах, расслабляя спастичные мышцы. Моторные блоки после периневрального введения анестетиков дают возможность оценить степень спастичности. Этот метод особенно полезен в прогнозировании нового функционального баланса и моделировании при лечении препаратами ботулотоксина. Инъекция анестетика в область смешанного нерва вызывает полную блокаду импульса в течение нескольких часов. В свою очередь ботулотоксин, введенный в мышцу-мишень, ингибирует выброс ацетилхолина в нейромышечных синапсах и вызывает денервацию на 3-6 мес. Поэтому в неоднозначных клинических ситуациях использование моторного блока мышцы-мишени с помощью регионарной блокады соответствующего нервного ствола или сплетения позволяет спрогнозировать эффект ботулинотерапии и избежать мышечного дисбаланса в результате длительной денервации «не той» мышцы.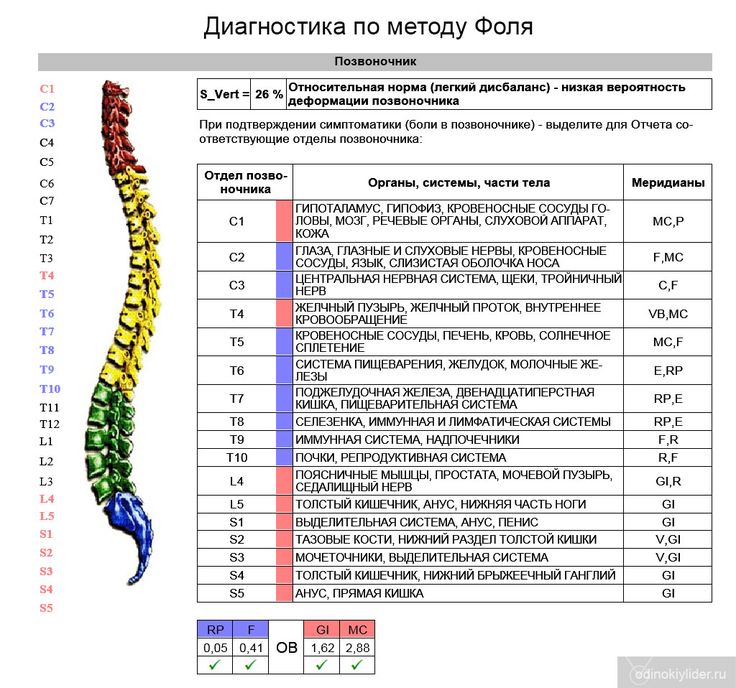
Сбалансированная анестезия с использованием регионарных блокад — это почти идеальный комплекс для оперативного вмешательства любой продолжительности у детей с ДЦП. Доказательством этому может служить удельный вес сбалансированной анестезии на основе регионарных блокад при оперативных вмешательствах у детей с ДЦП. По данным Научно-практического центра детской неврологии Департамента здравоохранения Москвы, который на протяжении четверти века является основной клиникой, осуществляющей хирургическую коррекцию конечностей у больных ДЦП, удельный вес сбалансированного обезболивания на основе регионарных блокад за последние 6 лет составил более 85% от общего числа проведенных анестезий.
АЛЛЕРГИЯ И АНЕСТЕЗИЯ
Аллергия и анестезияЛин Хеиз Гарви
Датский Центр Аллергии Анестезии, Копенгаген, Дания
Перевод Антипин Э.Э.
Введение
Аллергические реакции во время анестезии часто представляют диагностическую проблему из-за циркуляторных и дыхательных эффектов препаратов для анестезии, маскирующих симптомы анафилаксии. Благоприятный исход зависит от своевременной диагностики и правильного выбранного лечения реакции [1]. У всех препаратов, используемых во время проведения анестезии, есть потенциал, чтобы вызвать аллергические реакции. Тем не менее, реакции на отдельные препараты встречаются редко, и внимание должно быть сосредоточено на обеспечении своевременной диагностики и лечении анафилаксии во время анестезии.
Благоприятный исход зависит от своевременной диагностики и правильного выбранного лечения реакции [1]. У всех препаратов, используемых во время проведения анестезии, есть потенциал, чтобы вызвать аллергические реакции. Тем не менее, реакции на отдельные препараты встречаются редко, и внимание должно быть сосредоточено на обеспечении своевременной диагностики и лечении анафилаксии во время анестезии.
Лин Хеиз Гарви
Датский Центр Аллергии Анестезии, Копенгаген, Дания
Перевод Антипин Э.Э.
Введение
Аллергические реакции во время анестезии часто представляют диагностическую проблему из-за циркуляторных и дыхательных эффектов препаратов для анестезии, маскирующих симптомы анафилаксии. Благоприятный исход зависит от своевременной диагностики и правильного выбранного лечения реакции [1]. У всех препаратов, используемых во время проведения анестезии, есть потенциал, чтобы вызвать аллергические реакции. Тем не менее, реакции на отдельные препараты встречаются редко, и внимание должно быть сосредоточено на обеспечении своевременной диагностики и лечении анафилаксии во время анестезии. После успешного лечения предполагаемой аллергической реакции во время анестезии должны быть предприняты исследования, чтобы определить причину реакции с целью предотвратить в будущем риск ее развития. В связи со специфичностью этих исследований, они должны быть проведены в центрах специалистами, которые являются экспертами в области анестезиологии и аллергологии. Только в некоторых странах, таких как Франция, Австралия, Норвегия, Великобритания и Дания есть такие специализированные центры.
Тем не менее, реакции на отдельные препараты встречаются редко, и внимание должно быть сосредоточено на обеспечении своевременной диагностики и лечении анафилаксии во время анестезии. После успешного лечения предполагаемой аллергической реакции во время анестезии должны быть предприняты исследования, чтобы определить причину реакции с целью предотвратить в будущем риск ее развития. В связи со специфичностью этих исследований, они должны быть проведены в центрах специалистами, которые являются экспертами в области анестезиологии и аллергологии. Только в некоторых странах, таких как Франция, Австралия, Норвегия, Великобритания и Дания есть такие специализированные центры.
Определение и выраженность
Существует много различных определений аллергической реакции такие как анафилактическая, анафилактоидная, псевдо-аллергическая, гистаминоподобная и т.д, которые могут быть найдены в литературе, описывающей индивидуальные различия лежащих в основе механизмах развития. Поскольку эта терминология вносила путаницу в новую классификацию, был предложен более широкий термин «реакция гиперчувствительности». Реакции гиперчувствительности могут быть разделены на аллергические и неаллергические. Аллергические реакции могут быть IgE-опосредованные и не IgE-опосредованные. Термин анафилаксия используется в качестве основного для тяжелых, генерализованных и опасных для жизни реакций и относится к категории аллергических реакций гиперчувствительности. Большинство реакций, связанных с анестезией, является аллергическими реакциями гиперчувствительности. В этой статье, ради простоты, термин аллергическая реакция будет использоваться для описания аллергических реакций гиперчувствительности, тогда как анафилаксия будет использоваться, для описания тяжелых опасных для жизни реакций.
Поскольку эта терминология вносила путаницу в новую классификацию, был предложен более широкий термин «реакция гиперчувствительности». Реакции гиперчувствительности могут быть разделены на аллергические и неаллергические. Аллергические реакции могут быть IgE-опосредованные и не IgE-опосредованные. Термин анафилаксия используется в качестве основного для тяжелых, генерализованных и опасных для жизни реакций и относится к категории аллергических реакций гиперчувствительности. Большинство реакций, связанных с анестезией, является аллергическими реакциями гиперчувствительности. В этой статье, ради простоты, термин аллергическая реакция будет использоваться для описания аллергических реакций гиперчувствительности, тогда как анафилаксия будет использоваться, для описания тяжелых опасных для жизни реакций.
Аллергические реакции во время анестезии встречаются достаточно редко, однако, истинный уровень их развития трудно оценить из-за недостаточной диагностики, низкой отчетности и различий в методиках исследования и определения. Предполагаемый уровень аллергических реакций во время анестезии, основанный на направлениях в анестезиологические центры аллергии, располагается между 1:1 250 и 1:13 000 анестезий [3].В недавнем проспективном исследовании, проведенном более двух лет назад во Франции, регистрировались все случаи аллергии или неблагоприятные эффекты, связанные с проведением 70000 анестезий. Сообщалось, что частота аллергических реакций в этой больнице составила 1:3 180 анестезией [4].
Предполагаемый уровень аллергических реакций во время анестезии, основанный на направлениях в анестезиологические центры аллергии, располагается между 1:1 250 и 1:13 000 анестезий [3].В недавнем проспективном исследовании, проведенном более двух лет назад во Франции, регистрировались все случаи аллергии или неблагоприятные эффекты, связанные с проведением 70000 анестезий. Сообщалось, что частота аллергических реакций в этой больнице составила 1:3 180 анестезией [4].
Причины
Все анестетики и другие вещества, используемые во время анестезии и операции, обладают аллергическим потенциалом. Миорелаксанты, латекс, антибиотики, снотворные средства, анальгетики, дезинфицирующие средства (например, хлоргексидин), красители (например, метиленовый-синий), коллоиды и даже средства для стерилизации (например, оксид этилена) могут быть причиной развития реакции. Реакции на местные анестетики очень редко являются аллергическими, чаще это вазовагальная реакция или непреднамеренное внутрисосудистое введение препарата.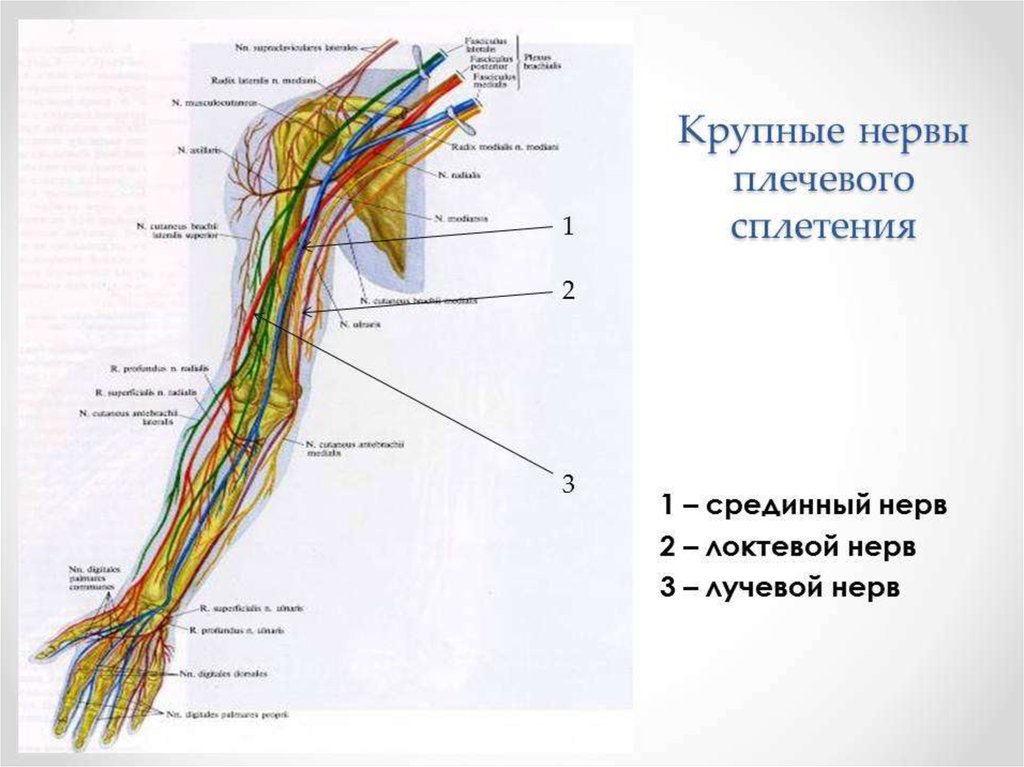 Существуют также географические особенности, и, в таких странах как Франция, Австралия, Норвегия и Великобритания, безусловно, миорелаксанты являются наиболее распространенной причиной развития аллергических реакций. В Дании в большинстве случаев отмечается аллергия на хлоргексидин, латекс и антибиотики, в значительной степени из-за их широкого использования во время анестезии и операции.
Существуют также географические особенности, и, в таких странах как Франция, Австралия, Норвегия и Великобритания, безусловно, миорелаксанты являются наиболее распространенной причиной развития аллергических реакций. В Дании в большинстве случаев отмечается аллергия на хлоргексидин, латекс и антибиотики, в значительной степени из-за их широкого использования во время анестезии и операции.
Гипотеза миорелаксантов и фолкодина
Хотя использование миорелаксантов ограничено исключительно общей анестезией, реакции на эти препараты могут, по-видимому, произойти без предшествующего использования. Это привело к гипотезе о существовании вещества, вызывающего перекрестную сенсибилизацию, которая могла повышать чувствительность пациентов к миорелаксантам самостоятельно в отсутствие их непосредственного введения. Эта теория была предложена в 1983, когда предположили, что четвертичный ион аммония может быть таким агентом [5]. Четвертичный ион аммония присутствует в большом количестве продуктов, домашних химикатов, дезинфицирующих средств и промышленных материалах.
Позже были исследованы различия в сенситизации к миорелаксантам в Норвегии, где этот уровень высок, и в Швеции, где уровень низок, для поиска определенынх антител против морфина и суксаметония, которые оба содержат четвертичный ион аммония. Антитела обнаруживались больше обычного у норвежских доноров и пациентов, склонных к аллергии [6]. Впоследствии проводился поиск, чтобы идентифицировать препарат или состав, который, возможно, вызвал сенситизацию к четвертичному иону аммония у норвежцев. Фолкодин, элемент лекарства от кашля, широко продавался в Норвегии, но не в Швеции и подозревали, что он и является сенсибилизирующим агентом. «Гипотеза фолкодина» проистекала из предположения, что потребление лекарств, содержащих фолкодин, могло привести к увеличению распространенности антителIgE не только к фолкодину, но также и к морфию и суксаметонию, приводя к увеличению риска анафилаксии к миорелаксантам из-за перекрестной реактивности. Было проведено мультицентровое исследование распространенности IgE антител к фолкодину, морфину и суксаметонию у пациентов с атопической аллергией. Во Франции и Норвеги, относительно высокая распространенность анафилаксии к миорелаксантам, отражающая высокое потребление фолкодина и относительно высокий процент атопических пациентов с IgE антителами к фолкодину. В Дании и Швеции, где отмечается относительно немного реакций на миорелаксанты, сообщалось, что фолкодин не продается, очень немногие пациенты имели IgE антитела к фолкодину [7].
Во Франции и Норвеги, относительно высокая распространенность анафилаксии к миорелаксантам, отражающая высокое потребление фолкодина и относительно высокий процент атопических пациентов с IgE антителами к фолкодину. В Дании и Швеции, где отмечается относительно немного реакций на миорелаксанты, сообщалось, что фолкодин не продается, очень немногие пациенты имели IgE антитела к фолкодину [7].
Механизмы
Клинические признаки и лечение предполагаемой аллергической реакции во время анестезии не зависит от основного механизма. IgE- опосредованные аллергические реакции встречаются когда происходит взаимодействие аллергена, который обладает сродством к высокоаффинным специфичным рецепторам IgE на поверхности тучных клеток, приводящее к дегрануляции и выбросу вазоактивных медиаторов. Не IgE- опосредованные аллергические реакции и дегрануляция тучных клеток могут быть также опосредованы через IgG, систему комплемента (C5a и C3a), нейропептиды и определенные препараты [8]. Неаллергические реакции могут быть вызваны прямым фармакологическим или ‘токсическим’ повреждением тучных клеток или базофилов [2]. Определение точного ответственного механизма полезно, чтобы планировать поведения будущей анестезии. В случаях, где лекарственное средство дает положительный результат при исследовании при помощи различных методик и подозревается IgE-опосредованная реакция, будущего введения данного лекарственного средства необходимо избегать, потому что риск аллергической реакции слишком высок. С другой стороны, большинство опиоидов, как известно, вызывает выброс гистамина тучными клетками, и эти реакции могут обычно предотвращаться медленной инъекцией и предварительным введением антигистаминных средств [9].
Неаллергические реакции могут быть вызваны прямым фармакологическим или ‘токсическим’ повреждением тучных клеток или базофилов [2]. Определение точного ответственного механизма полезно, чтобы планировать поведения будущей анестезии. В случаях, где лекарственное средство дает положительный результат при исследовании при помощи различных методик и подозревается IgE-опосредованная реакция, будущего введения данного лекарственного средства необходимо избегать, потому что риск аллергической реакции слишком высок. С другой стороны, большинство опиоидов, как известно, вызывает выброс гистамина тучными клетками, и эти реакции могут обычно предотвращаться медленной инъекцией и предварительным введением антигистаминных средств [9].
Клинические признаки и симптомы
Признаки и симптомы аллергических реакций, развивающихся во время анестезии, включают любую комбинацию сердечно-сосудистых, дыхательных, кожных или желудочно-кишечных нарушений, как и при аллергических реакциях, которые встречаются вне операционной. Однако, кожные симптомы часто скрыты операционным бельем, а желудочно-кишечные симптомы не обязательно будут очевидными у пациента под воздействием анестезии. Дыхательные, циркуляторные и кожные признаки бывает трудно отличить от «нормальных» реакций на анестетики или миорелаксанты. Тяжесть симптомов может колебаться от умеренных высыпаний в послеоперационном периоде до сердечно-сосудистого коллапса или тяжелого бронхоспазма, встречающихся при индукции в анестезию, которая устойчивых к обычному лечению. В случаях только циркуляторных нарушений могут появиться кожные признаки, как только гемодинамика будет стабилизирована. Серьезность реакций может зависеть от механизма, вызывающего реакцию, аллергена и пути его введения. IgE- опосредованные реакции на лекарства, вводимые внутривенно, более других ассоциируются с быстро развивающейся тяжелой гипотензией чем неIgE-опосредованные [10].
Однако, кожные симптомы часто скрыты операционным бельем, а желудочно-кишечные симптомы не обязательно будут очевидными у пациента под воздействием анестезии. Дыхательные, циркуляторные и кожные признаки бывает трудно отличить от «нормальных» реакций на анестетики или миорелаксанты. Тяжесть симптомов может колебаться от умеренных высыпаний в послеоперационном периоде до сердечно-сосудистого коллапса или тяжелого бронхоспазма, встречающихся при индукции в анестезию, которая устойчивых к обычному лечению. В случаях только циркуляторных нарушений могут появиться кожные признаки, как только гемодинамика будет стабилизирована. Серьезность реакций может зависеть от механизма, вызывающего реакцию, аллергена и пути его введения. IgE- опосредованные реакции на лекарства, вводимые внутривенно, более других ассоциируются с быстро развивающейся тяжелой гипотензией чем неIgE-опосредованные [10].
Лечение
Если во время анестезии происходит аллергическая реакция, необходима своевременная диагностика, обеспечение надежного внутривенного доступа, и анестезиологический персонал, специально обученный действиям в экстренных ситуациях, должен быть готов к оказанию немедленной помощи.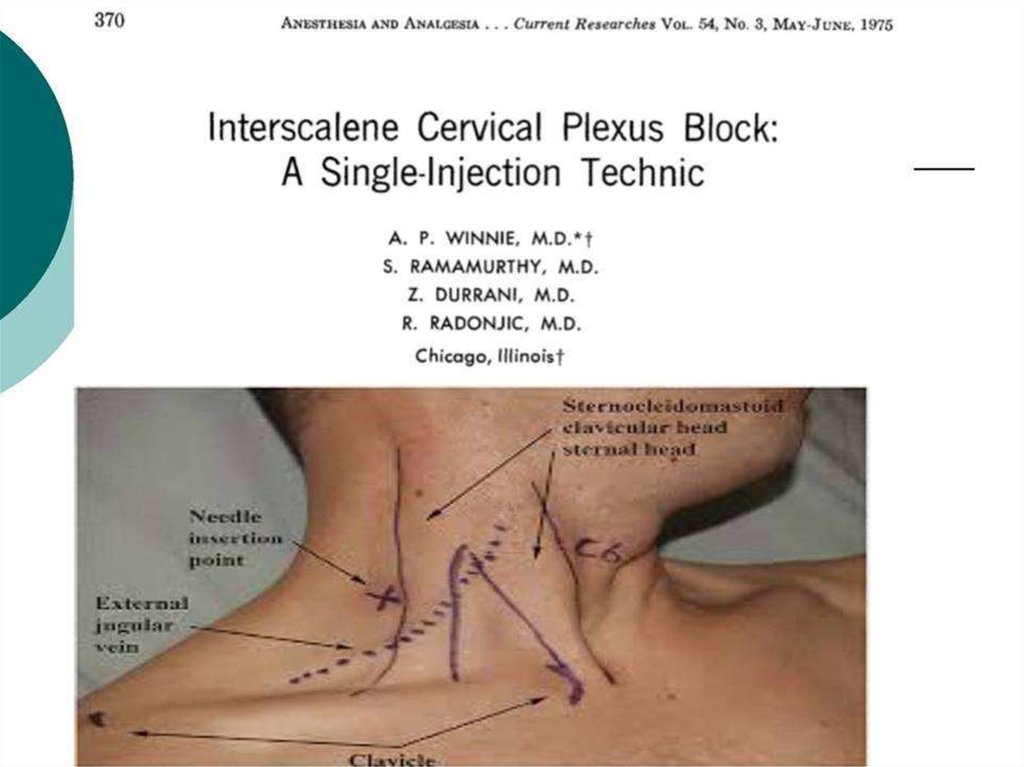 Это должно обеспечить оптимальные условия для эффективного лечения, как только анафилаксия была диагностирована. Лечение зависит от клинической тяжести реакции. Для тяжелых реакций с сердечнососудистыми или дыхательными нарушениями лечение первой линии заключается во внутривенном введении адреналина, начинающегося с болюсов 0.01-0.05 мг (10-50 µg) титруемых до достижения эффекта. В случаях неэффективности дозы должны быть увеличены до 0.1-0.2 мг (100-200 µg), и необходимо рассмотреть возможность непрерывной инфузии адреналина[1]. Оксигенация должна быть максимальной при обеспечении проходимости дыхательных путей и при предоставлении 100%-ого кислорода. Подъем ног и внутривенная инфузия жидкостей применяются в дополнение к вазоконстрикторным эффектам адреналина.
Это должно обеспечить оптимальные условия для эффективного лечения, как только анафилаксия была диагностирована. Лечение зависит от клинической тяжести реакции. Для тяжелых реакций с сердечнососудистыми или дыхательными нарушениями лечение первой линии заключается во внутривенном введении адреналина, начинающегося с болюсов 0.01-0.05 мг (10-50 µg) титруемых до достижения эффекта. В случаях неэффективности дозы должны быть увеличены до 0.1-0.2 мг (100-200 µg), и необходимо рассмотреть возможность непрерывной инфузии адреналина[1]. Оксигенация должна быть максимальной при обеспечении проходимости дыхательных путей и при предоставлении 100%-ого кислорода. Подъем ног и внутривенная инфузия жидкостей применяются в дополнение к вазоконстрикторным эффектам адреналина.
Анафилаксию во время анестезии бывает трудно диагностировать, лечение может быть несвоевременным и привести к неблагоприятным последствиям. В первую очередь анафилаксию необходимо рассматривать в качестве дифференциального диагноза в случае циркуляторной недостаточности, устойчивой к обычному лечению, такому как использование эфедрина, фенилэфрина, инфузии жидкости и повышение ног пациента в течение 10 минут [11]. Если никакой другой очевидной причины нет, и анафилаксия не может быть исключена, необходимо начать лечение адреналином в дозе 0.01 мг (10 µg) и титруемой по эффекту. Поскольку адреналин является не только средством спасения жизни, но также и чрезвычайно сильнодействующим лекарственным средством с потенциально смертельными побочными эффектами [10, 12], все анестезисты должны быть обучены правильному разбавлению и применению адреналина.
Если никакой другой очевидной причины нет, и анафилаксия не может быть исключена, необходимо начать лечение адреналином в дозе 0.01 мг (10 µg) и титруемой по эффекту. Поскольку адреналин является не только средством спасения жизни, но также и чрезвычайно сильнодействующим лекарственным средством с потенциально смертельными побочными эффектами [10, 12], все анестезисты должны быть обучены правильному разбавлению и применению адреналина.
Внутривенные антигистаминные препараты и стероиды должны применяться как лечение второй линии и используются для ослабления кожных симптомов и предотвращения рецидивов анафилаксии, которая может повториться в пределах с 24 часов. При умеренных реакциях, ограниченных кожными симптомами или отеком лица или оконечностей, антигистаминные средства и стероиды могут быть назначены как лечение первой линии, пока пациент наблюдается близко для прогрессии симптома. Продолжение или отмена операции и послеоперационного наблюдения зависят от серьезности реакции и эффективности лечения. Необходимо всегда рассматривать направление к врачу специалисту для исследования аллергии, и сообщать об этом пациенту.
Необходимо всегда рассматривать направление к врачу специалисту для исследования аллергии, и сообщать об этом пациенту.
Когда анафилаксия встречается вне операционной, аллерген часто можно идентифицировать. В этой ситуации выделяется часто единственный агент, например укус насекомого или инъекция на догоспитальном этапе или в палате стационара общего профиля. Диагноз может быть поставлен быстро и в большинстве случаев достоверно, и рекомендуемым лечением первой линии анафилаксии в этом случае является внутримышечное введение адреналина 0.3 мг (300 µg) [13, 14]. Введение адреналина в указанной дозе и таким путем является наиболее безопасным и приемлемым у пациентов без контролируемого внутривенного доступа. Этот подход отражает лечение пациентов, у которых известна анафилаксия , например к яду насекомого или арахису и, в данном контексте, адреналин часто применяется самостоятельно.
Диагноз и исследования
Триптаза сыворотки
В некоторых случаях клиническая наблюдаемая реакция явно наводит на мысль о развитии анафилаксии, но во многих случаях диагноз вызывает трудности. Когда встречаются IgE-опосредованные реакции, повышается уровень триптазы сыворотки крови, которая выбрасывается тучными клетками вместе с гистамином и другими медиаторами, и, оказалось, что она является полезным маркером в случаях подозрения на развитие аллергической реакции во время анестезии.
Когда встречаются IgE-опосредованные реакции, повышается уровень триптазы сыворотки крови, которая выбрасывается тучными клетками вместе с гистамином и другими медиаторами, и, оказалось, что она является полезным маркером в случаях подозрения на развитие аллергической реакции во время анестезии.
Пики уровня триптазы сыворотки между 30 минутами и с 2 часами после реакции, соответственно образец крови должен быть спустя 30 минут и не позже 3 часов после реакции. Уровень триптазы коррелирует с тяжестью гипотензии и , в случае развития тяжелой реакции уровень триптазы в сыворотке крови может оставаться высоким в течение 24 часов после реакции [1]. Поскольку сывороточная триптаза очень устойчива и может сохраняться в течение нескольких дней при комнатной температуре, то сыворотка может быть отправлена на анализ как только состояние пациента будет стабилизировано. Для правильной интерпретации значений триптазы, очень важно точно зафиксировать время развития реакции и время забора крови на анализ. Уровень триптазы сыворотки должен всегда сравниваться с образцом, взятым спустя несколько дней после того, как реакция стихла. Существуют небольшие изменение в базальном уровне триптазы сыворотки у отдельных пациентов, поэтому даже относительно малое увеличение, более чем 2.2 µg/l от начального значения может быть значительным, даже когда нормальное справочное значение является меньше чем 11.4 µg/l [15].
Уровень триптазы сыворотки должен всегда сравниваться с образцом, взятым спустя несколько дней после того, как реакция стихла. Существуют небольшие изменение в базальном уровне триптазы сыворотки у отдельных пациентов, поэтому даже относительно малое увеличение, более чем 2.2 µg/l от начального значения может быть значительным, даже когда нормальное справочное значение является меньше чем 11.4 µg/l [15].
Послеоперационное исследование
Когда пациенты нуждаются в исследовании после предполагаемой аллергической реакции во время анестезии, важно собрать подробную информацию о реакции, времени развития, симптомах, методах и эффективности лечения. При разработке плана исследования, необходимо также рассматривать все препараты и вещества, которые применялись до развития реакции. Всвязи с отсутствием единственного анализа, золотого стандарта, для исследования этих реакций, необходимо использовать комбинацию методик, с целью увеличить чувствительность и избежать ложных результатов исследований, которые могут создавать угрозу для пациента во время последующей анестезии. Сопутствующее недостатки специфичности тестов обычно приемлемы, поскольку ложноположительный результат теста приведет к ограничению в выборе препаратов для последующих процедур, что, вероятно, редко вызовет проблемы.
Сопутствующее недостатки специфичности тестов обычно приемлемы, поскольку ложноположительный результат теста приведет к ограничению в выборе препаратов для последующих процедур, что, вероятно, редко вызовет проблемы.
Исследование предполагаемых аллергических реакций во время анестезии является специализированным и длительным процессом. В настоящее время только в некоторых странах есть стандартизированный протокол исследований, и еще меньше есть центров по исследованию этих реакций. Исследования основаны на комбинации анализов крови (определение уровня триптазы и специфических Ig, тест активации базофилов), кожные пробы (тест-прик, внутрикожные пробы). В датском Центре Аллергии и Анестезии (DAAC) систематические провокационные тесты лекарственных средств также включены в рутинные исследования.
При интерпретации результатов любого исследования все результаты испытаний рассматриваются в контексте наблюдаемой клинической реакции, что гарантирует точность результата. Пациентам нужно сообщить о результатах и их значении и должен быть выдан список противопоказанных препаратов. Кроме того, пациенты, обследованные в DAAC, выписываются с детализированным письмом, описывающим реакцию, которая привела к направлению к врачу специалисту, включая симптомы, препараты, вызвавшие реакцию и предпринятое лечение. Информация о результатах тестов и заключениях исследований также включена в письмо.
Пациентам нужно сообщить о результатах и их значении и должен быть выдан список противопоказанных препаратов. Кроме того, пациенты, обследованные в DAAC, выписываются с детализированным письмом, описывающим реакцию, которая привела к направлению к врачу специалисту, включая симптомы, препараты, вызвавшие реакцию и предпринятое лечение. Информация о результатах тестов и заключениях исследований также включена в письмо.
Это оказалось очень полезным особенно в случаях, где не было найдено никакой причина для развития реакции. Во многих случаях определяются другие вероятные объяснения гипотензии или бронхоспазма, и при дифференциальной диагностике необходимо учитывать следующие причины — кровотечение, гиповолемия, сопутствующее применение трициклических антидепрессантов или ингибиторов АПФ, преувеличенная физиологическая реакция на окситоцин или неправильная диагностика и лечение астмы.
Профилактика
Риск будущих аллергических реакций во время анестезии увеличивается у больных с предыдущей реакцией [16]. Если были проведены тесты и причина найдена, то при последующей анестезии данный препарат не должен использоваться. Если причина не была найдена, а реакция предположительно имела аллергическую природу, рекомендуется предварительное назначение антигистаминных средств и стероидов. Однако, нет никаких доказательств высокого уровня профилактического эффекта их предварительного назначения из-за редкой, неожиданной и опасной для жизни природы анафилаксии. Маловероятно, что высокий уровень доказательств когда-либо будет доступным в этой области [1].
Если были проведены тесты и причина найдена, то при последующей анестезии данный препарат не должен использоваться. Если причина не была найдена, а реакция предположительно имела аллергическую природу, рекомендуется предварительное назначение антигистаминных средств и стероидов. Однако, нет никаких доказательств высокого уровня профилактического эффекта их предварительного назначения из-за редкой, неожиданной и опасной для жизни природы анафилаксии. Маловероятно, что высокий уровень доказательств когда-либо будет доступным в этой области [1].
Если пациент, перенесший аллергическую реакцию, не был обследован или не была найдена причина, то может быть оправданным ограничение применения предполагаемых аллергенов в будущем. Предполагаемые причины аллергических реакций во время предыдущей анестезии могут представлять опасность в будущем, и рекомендация состоит в том, чтобы избегать применения всех препаратов и веществ, которые возможно были причиной развития реакции ранее[17].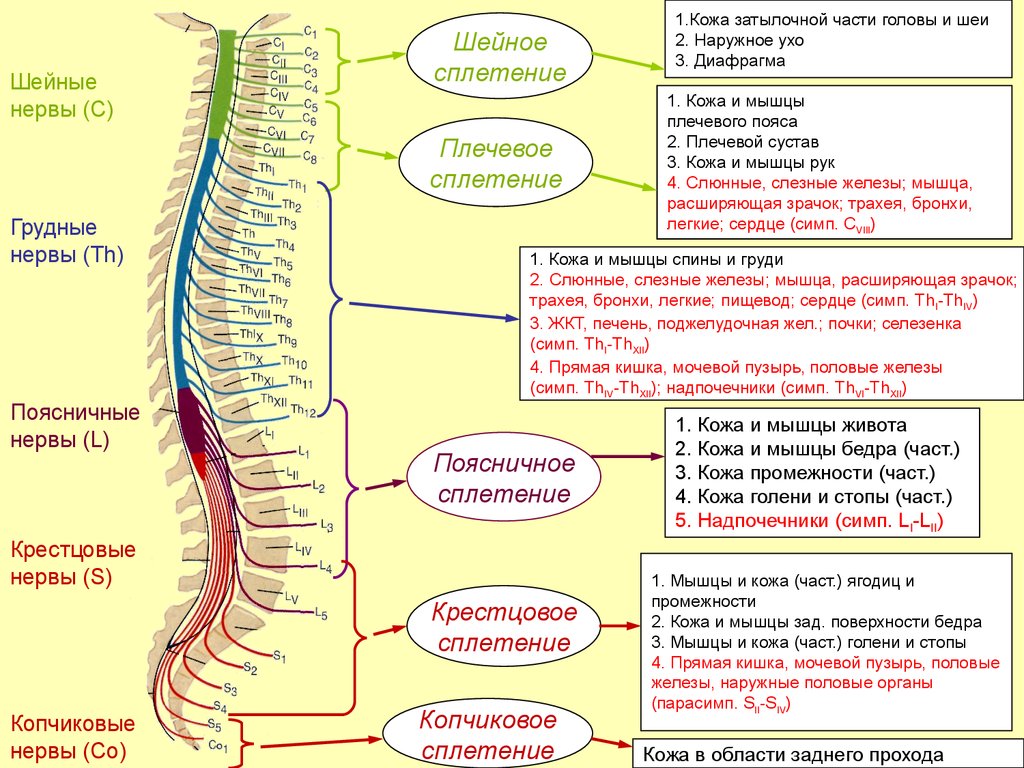 Анестезиологи должны быть готовы быстро диагностировать и лечить анафилаксию. Недавно изданы скандинавские алгоритмы ведения пациентов, имевших тяжелые аллергические реакции во время анестезии [1].
Анестезиологи должны быть готовы быстро диагностировать и лечить анафилаксию. Недавно изданы скандинавские алгоритмы ведения пациентов, имевших тяжелые аллергические реакции во время анестезии [1].
Многие пациенты сообщают, об «аллергии» на различные препараты и вещества перед предстоящей операцией, но большинство из них не имеют аллергической природы, такие как тошнота и рвота от морфина, диарея от пенициллина или вздутие от приема парацетамола. Доказанная аллергия на один или более препаратов является редкой и не увеличивает риск реакции во время анестезии, если не применяются потенциально перекрестно-реактивные препараты. Многие пациенты говорят об аллергии на местные анестетики, которые при более детальном опросе могут часто являться вазовагальной реакцией или эффектом случайной внутрисосудистой инъекции непосредственно местного анестетика, или, используемого в качестве вазоконстриктора, адреналина. Истинная аллергия на местные анестетики очень редкое явление, но подозрение на аллергию может представлять диагностическую дилемму для анестезиолога, особенно при Кесаревом сечении по экстренным показаниям, проводимого с использованием регионарных методик.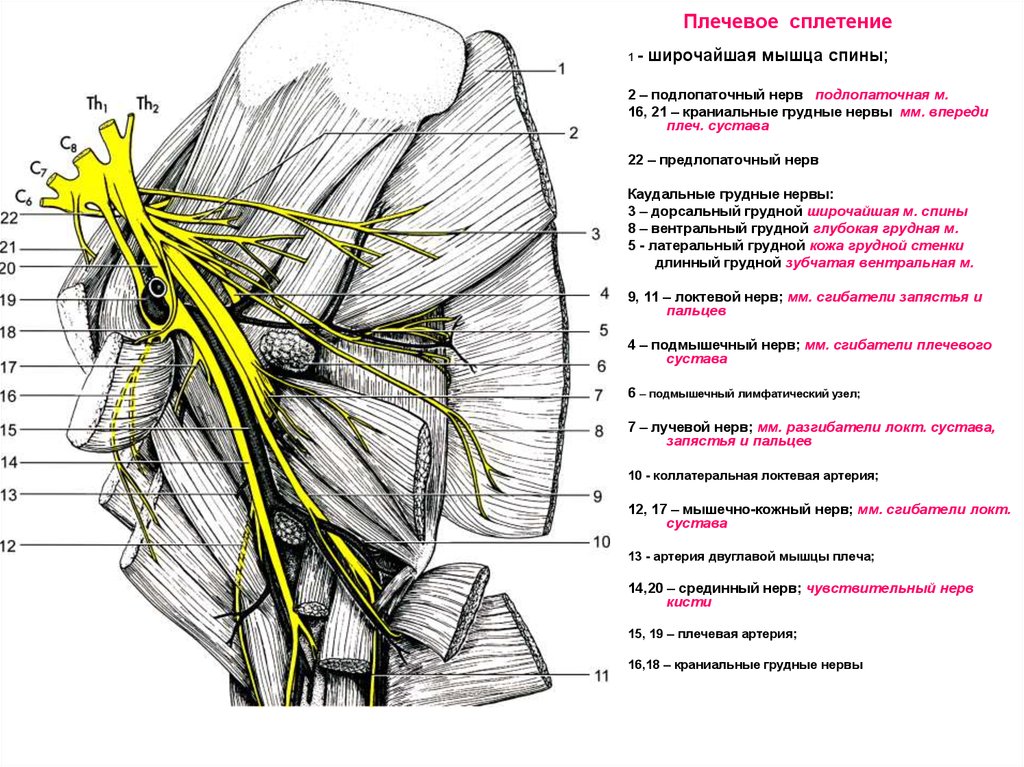 Потенциальные судебно-медицинские последствие использования местного анестетика у пациентки, которая настаивает на аллергии, не должно превышать опасности осложнений использования препаратов для общей анестезии у пациентки с высоким риском трудной интубации, аспирации и др. Если это возможно, то должно быть гарантировано дооперационное тестирование с местным анестетиком.
Потенциальные судебно-медицинские последствие использования местного анестетика у пациентки, которая настаивает на аллергии, не должно превышать опасности осложнений использования препаратов для общей анестезии у пациентки с высоким риском трудной интубации, аспирации и др. Если это возможно, то должно быть гарантировано дооперационное тестирование с местным анестетиком.
С другой стороны, некоторые пациенты, самостоятельно не информируют, например, о возможной аллергии на латекс, так как считают такие симптомы как зуд от ношения резиновых перчаток или опухшие губы от разрыва воздушных шариков, несущественными[4]. Эти пациенты, если они не выявлены заранее, могут впоследствии реагировать на латекс во время операции. Простое выяснение у пациента информации, если у него какая-либо аллергия, может избавить от заблуждений в дальнейшем. Для анестезиолога важно попытаться идентифицировать симптомы аллергии и задавать соответствующие вопросы, например: «Вы когда-либо испытывали зуд кожи, глаз, горла или носа?» или «У Вас когда-либо были высыпание или набухание какой-либо части тела после контакта или употребления пищи или препаратов?»
Также полезно выяснять аллергические симптомы при воздействии специфических агентов, таких как антибиотики, латекс или средств дезинфекции. Пациенты, самостоятельно утверждающие, что у них есть «аллергия на анестезию», в большинстве случаев или перенесли тяжелый PONV или имели опыт долгого пребывании в стационаре и восстановления из-за эффектов предыдущего лечения, анестезии или послеоперационного обезболивания. Эти пациенты, очевидно, нуждаются в образовании и заверении в том, что у них нет симптомов аллергии.
Пациенты, самостоятельно утверждающие, что у них есть «аллергия на анестезию», в большинстве случаев или перенесли тяжелый PONV или имели опыт долгого пребывании в стационаре и восстановления из-за эффектов предыдущего лечения, анестезии или послеоперационного обезболивания. Эти пациенты, очевидно, нуждаются в образовании и заверении в том, что у них нет симптомов аллергии.
Нет никаких доказательств, чтобы отказаться от использования препаратов, которым приписываются особые аллергические свойства и передаются из уст в уста в анестезиологической среде. Несколько лет назад в международной литературе проводились цветистые дебаты относительно риска реакций, связанных с миорелаксантом рокурониумом, [18, 19].Общий риск аллергических реакций во время анестезии очень низкий, даже для миорелаксантов в странах с более высокой распространенностью этих аллергий. В Норвегии например, когда миорелаксанты использовались в качестве части анестезиологической методики, была вычислена частота развития реакций на эти препараты, и составила1:5 200 препаратов для анестезии[20].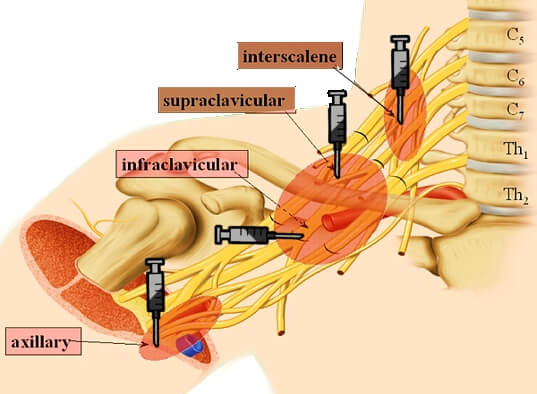 Все препараты и вещества могут потенциально вызвать анафилаксию во время анестезии, и реакции на них непредсказуемы. Акценты должны быть смещены от инкриминации аллергических свойств отдельным препаратам или группам лекарственных средства в пользу улучшения диагностики и лечения аллергических реакций.
Все препараты и вещества могут потенциально вызвать анафилаксию во время анестезии, и реакции на них непредсказуемы. Акценты должны быть смещены от инкриминации аллергических свойств отдельным препаратам или группам лекарственных средства в пользу улучшения диагностики и лечения аллергических реакций.
Ключевые пункты лекции
- Анафилаксия во время анестезии – редкая, но труднодиагностируемая реакция.
- Анафилаксия должна подозреваться в случаях тяжелой упорной гипотензии, резистентной к обычному лечению с использованием эфедрина и нагрузкой жидкостью, если нет другой очевидной причины.
- Лечение первой линии при анафилаксии (ассоциированной с циркуляторными и/или респираторными симптомами) является болюсное внутривенное введение адреналина, начинающегося с дозы 0.01-0.05 мг (10-50 µg) и титруемое по эффекту.
- Триптаза сыворотки может помочь подтвердить анафилаксию, и образец крови должен быть взят между 30 минутами и 3 часами после реакции.
 Время забора проб на анализ должно быть отмечено относительно времени развития реакции. Значения должны всегда сравниваться с базовыми, полученными позднее, после того как реакция будет купирована.
Время забора проб на анализ должно быть отмечено относительно времени развития реакции. Значения должны всегда сравниваться с базовыми, полученными позднее, после того как реакция будет купирована. - Пациенты должны быть обследованы в послеоперационном периоде, чтобы определить причину реакции. Такое исследование является очень специализированным и, в идеале, должно проводиться в сотрудничестве между анестезиологами и аллергологами.
References
1. Harrison NL. General anesthetics: mechanisms of action. In: Foundations of Anesthesia, 2nd edn. Hemmings HC, Hopkins PM (eds). Mosby Elsevier: Philadephia 2006, 287-94.
2. Rodolf U, Antkowiak B. Molecular and neuronal substrates for general anaesthetics. Nature Review Neuroscience 2004; 5: 709-20.
3. Franks NP, Leib WR. Inhibitory synapses. Anaesthetics set their sites on ion channels. Nature 1997; 389: 334-5.
4. Campagna JA, Miller KW, Forman SA.
 Mechanisms of action of inhaled anesthetics. New England Journal Medicine 2003; 348:2110-24.
Mechanisms of action of inhaled anesthetics. New England Journal Medicine 2003; 348:2110-24.5. Jurd R, Arras M, Lambert S, et al. General anesthetic actions in vivo strongly attenuated by a point mutation in the GABAA receptor β3subunit. FASEB Journal 2002; 17: 250-2.
6. Orser B, Pennefather BS, MacDonald JF. Multiple mechanisms of ketamine blockade at NMDA receptors. Anesthesiology 1997; 86: 903-17
7. Perouansky M, Hemmings HC. Intravenous anesthetic agents. In: Foundations of Anesthesia, 2nd edn. Hemmings HC, Hopkins PM (eds). Mosby Elsevier: Philadephia 2006, 295-310.
8. Smith I. Inhalational anaesthetic agents. In: Foundations of Anesthesia, 2nd edn. Hemmings HC, Hopkins PM (eds). Mosby Elsevier; Philadephia 2006, 311-21.
9. Ghatge S, Lee J, Smith I. Sevofl urane: an ideal agent for adult daycase anesthesia? Acta Anaesthesiologica Scandinavica 2003; 47: 917-31.
10. Myles PS, Leslie K, Chan MT, Paech MJ, Forbes A, Peyton P.
 Avoidance of nitrous oxide for patients undergoing major surgery: arandomised controlled trial. Anesthesiology 2007; 107: 221-31.
Avoidance of nitrous oxide for patients undergoing major surgery: arandomised controlled trial. Anesthesiology 2007; 107: 221-31.11. Leslie K, Myles PS, Chan MT, et al. Nitrous oxide and long term morbidity and mortality in the ENIGMA trial. Anesthesia and Analgesia 2010 [epub ahead of print].
12. Myles PS, Leslie K, Chan MT, et al. Nitrous oxide and perioperative cardiac morbidity (ENIGMA-II) Trial: rationale and design. American Heart Journal 2009; 157: 488-94.
13. Sanders RD, Franks NP, Maze M. Xenon: no stranger to anaesthesia. British Journal of Anaesthesia 2003; 91: 709-17.
14. Sneyd JR, Rigby-Jones AE. New drugs and technologies, IV anaesthesia is on the move again. British Journal of Anaesthesia 2010; 105: 246-54.
15. Siegel LC. Konstantatos A. PFO713 produced rapid induction of general anestehsia without injection pain in a phase I study. Anesthesiology 2009; A463.
16. Cotton JF, Husain SS, Forman SA, et al.
 Methoxy-carbonyl etomidate: a novel rapidly metabolised ultra-short acting etomidate analogue that does not produce prolonged adrenocortical suppression. Anesthesiology 2009: 111: 240-9.
Methoxy-carbonyl etomidate: a novel rapidly metabolised ultra-short acting etomidate analogue that does not produce prolonged adrenocortical suppression. Anesthesiology 2009: 111: 240-9.17. Cotton JF, Forman SA, Laha JK, et al. Carboetomidate: A pyrrole analogue of etomidate designed not to suppress adrenocortical function. Anesthesiology 2010; 112: 637-44.
18. Wiard RP, Feldman PL, Collins H, et al. CNS 7056: a novel ultra short acting benzodiazepine. Anesthesiology 2007; 107: 60-6.
19. Perouansky M, Hemmings HC. Neurotoxicity of general anesthetics. Anesthesiology 2009; 111: 1365-71.
20. Hansen TG, Flick R. Anesthetic effects on the developing brain: Insights from epidemiology.Anesthesiology 2009; 110: 1-3
О процедуре блокады чревного сплетения
Эта информация поможет вам подготовиться к процедуре блокады чревного сплетения в центре Memorial Sloan Kettering (MSK), включая информацию о том, что следует ожидать до, во время и после процедуры.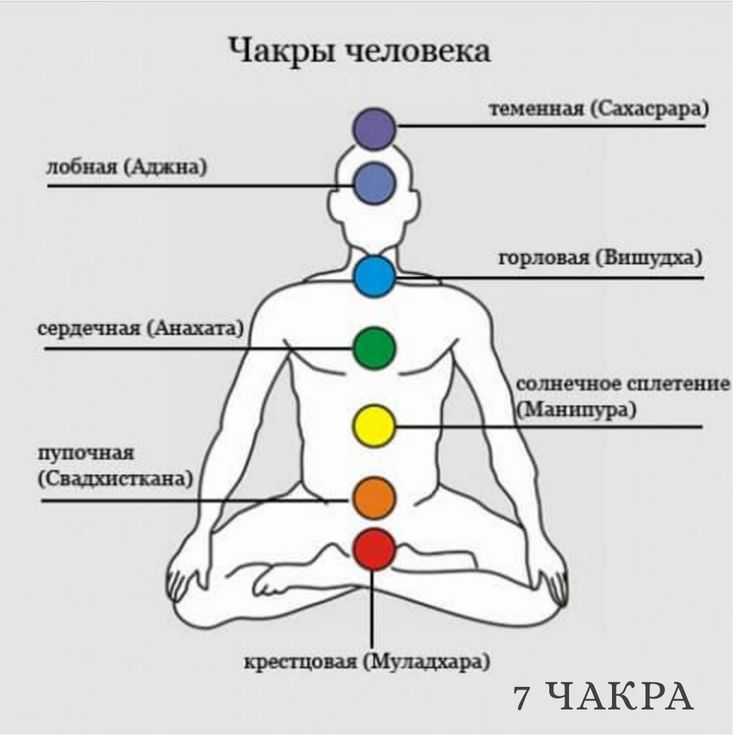
Чревное (солнечное) сплетение — это группа нервов в брюшной полости (животе). Он посылает сообщения о боли в ваш мозг. Эти болевые сообщения отправляются из вашего:
- Поджелудочной железы
- Печень
- Почки
- Желчный пузырь
- Селезенка
- Кишечник (кишечник)
Процедура блокады чревного сплетения
Блокада чревного сплетения — это инъекция (укол) лекарства, которое останавливает болевые ощущения в этих нервах. Это может помочь при болях в верхней части живота. Ваш врач может порекомендовать вам провести блокаду чревного сплетения, если вы:
- У вас есть побочные эффекты от обычных обезболивающих препаратов.
- Недостаточное обезболивание обычными обезболивающими препаратами.
Хотя проблемы с блокадой чревного сплетения встречаются редко, они могут включать:
- Повреждения крупных кровеносных сосудов, нервов или почек.
- Частичный коллапс легкого.

- Введение препарата для блокады нервов в кровеносный сосуд.
- Слабость в ногах.
- Проблемы с кишечником или мочевым пузырем.
- Аллергические реакции на лекарства или красители, используемые во время процедуры.
Ваш врач обсудит их с вами перед процедурой.
НаверхПеред процедурой
Спросите о ваших лекарствах
Возможно, вам придется прекратить прием некоторых лекарств перед процедурой. Поговорите со своим лечащим врачом о том, какие лекарства безопасно прекратить принимать. Ниже мы привели несколько распространенных примеров.
Разжижители крови
Разжижители крови — это лекарства, влияющие на свертываемость крови. Если вы принимаете препараты для разжижения крови, спросите у лечащего врача, что делать. Они могут порекомендовать вам прекратить прием лекарства. Это будет зависеть от типа предстоящей вам процедуры и причины, по которой вы принимаете препараты для разжижения крови.
Примеры препаратов для разжижения крови:
|
|
Не прекращайте прием препаратов для разжижения крови, не посоветовавшись с членом вашей бригады по уходу.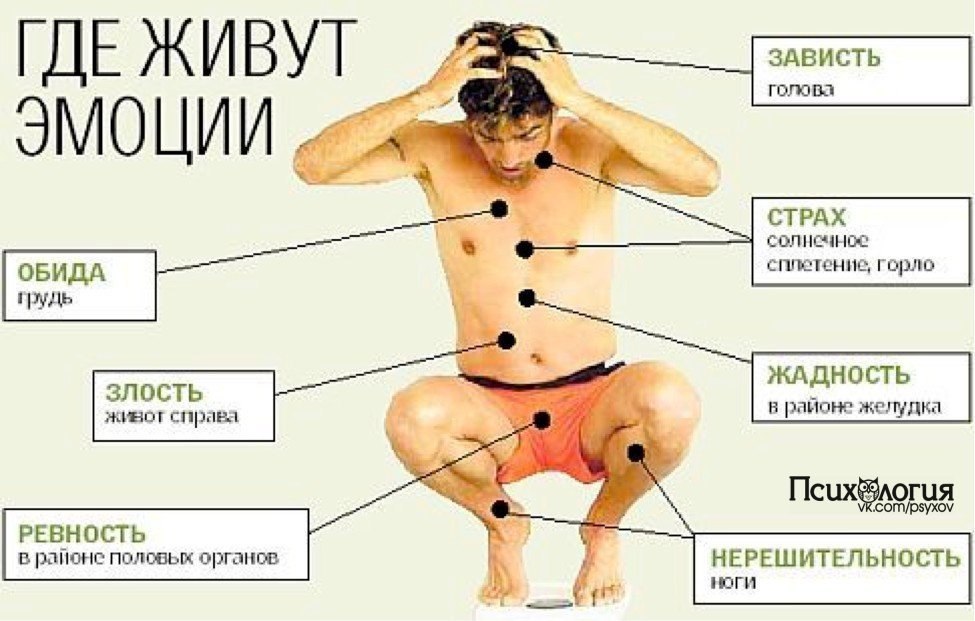
Ознакомьтесь с распространенными лекарствами, содержащими аспирин, другие нестероидные противовоспалительные препараты (НПВП) или витамин Е. В нем содержится информация о лекарствах, которых вам следует избегать перед процедурой. В нем также указано, какие лекарства вы можете принимать вместо них.
Лекарства от диабета
Перед процедурой поговорите с врачом, который пропишет вам инсулин или другие лекарства от диабета. Возможно, вам придется изменить дозу лекарств, которые вы принимаете от диабета. Спросите их, что вы должны делать утром перед процедурой.
Ваша медицинская бригада будет проверять уровень сахара в крови во время процедуры.
Диуретики (мочегонные таблетки)
Мочегонное — это лекарство, которое заставляет вас чаще мочиться. Гидрохлоротиазид (Микрозид ® ) и фуросемид (Lasix ® ) являются распространенными диуретиками.
Если вы принимаете какие-либо мочегонные средства, спросите у лечащего врача, что вам делать. Возможно, вам придется прекратить их прием в день процедуры.
Возможно, вам придется прекратить их прием в день процедуры.
Сделайте анализ крови перед процедурой
Ваш лечащий врач назначит вам сдать анализ крови за несколько дней до процедуры, чтобы проверить клетки, которые способствуют свертыванию крови (тромбоциты).
Удаление устройств с кожи
Если вы носите:
- Непрерывный глюкометр (CGM), поговорите с поставщиком медицинских услуг, который занимается лечением диабета, до вашего визита к врачу.
- Инсулиновая помпа.
Производитель рекомендует снять эти устройства с кожи перед сканированием или процедурой. Ваш лечащий врач расскажет вам, как контролировать уровень глюкозы, когда ваше устройство выключено. Они также могут помочь вам запланировать встречу ближе к дате, когда вам нужно сменить устройство.
Убедитесь, что у вас есть дополнительное устройство, которое можно надеть после сканирования или процедуры.
Организовать, чтобы кто-нибудь отвез вас домой
После процедуры вас должен отвезти домой ответственный партнер по уходу. Ответственный партнер по уходу — это тот, кто может помочь вам безопасно вернуться домой. Они должны иметь возможность связаться с вашей командой по уходу, если у них есть какие-либо проблемы. Обязательно запланируйте это до дня процедуры.
Ответственный партнер по уходу — это тот, кто может помочь вам безопасно вернуться домой. Они должны иметь возможность связаться с вашей командой по уходу, если у них есть какие-либо проблемы. Обязательно запланируйте это до дня процедуры.
Если у вас нет ответственного партнера по уходу, который отвезет вас домой, позвоните в одно из указанных ниже агентств. Они пришлют кого-нибудь домой с тобой. Эта услуга платная, и вам нужно будет предоставить транспорт. Можно использовать такси или автосервис, но вам все равно нужен ответственный партнер по уходу.
| Агентства в Нью-Йорке | Агентства в Нью-Джерси |
| Партнеры по уходу: 888-735-8913 | Заботливые люди: 877-227-4649 |
| Заботливые люди: 877-227-4649 |
Сообщите нам, если вы заболели
Если вы заболели (включая лихорадку, простуду, боль в горле или грипп) перед процедурой, позвоните своему лечащему врачу. Вы можете связаться с ними с понедельника по пятницу с до После , в выходные и праздничные дни звоните по телефону 212-639-2000 и попросите дежурного специалиста по интервенционной радиологии.
Вы можете связаться с ними с понедельника по пятницу с до После , в выходные и праздничные дни звоните по телефону 212-639-2000 и попросите дежурного специалиста по интервенционной радиологии.
Обратите внимание на время приема.
Сотрудник отдела интервенционной радиологии позвонит вам за 2 рабочих дня (с понедельника по пятницу) до процедуры. Если ваша процедура запланирована на понедельник, вам позвонят в предыдущий четверг. Если вам не позвонят до полудня рабочего дня перед процедурой, позвоните по номеру 646-677-7001.
Сотрудник сообщит вам, в какое время вы должны прибыть в больницу для проведения процедуры. Вам нужно пройти по адресу:
Presurgical Center (PSC) на 2 nd этаж
1275 York Avenue
(между East 67 th и East 68 th Streets)
Воспользуйтесь лифтом M06 до 6 2 90 nd floor
Если вам необходимо отменить процедуру по какой-либо причине, позвоните поставщику медицинских услуг, который запланировал ее для вас.
За день до процедуры
Инструкции по приему пищи перед процедурой
Ничего не ешьте после полуночи накануне процедуры. Сюда входят леденцы и жевательная резинка.
День процедуры
Инструкции по питью перед процедурой
Вы можете выпить в общей сложности 12 унций воды между полуночью и за 2 часа до запланированного времени прибытия. Не пейте больше ничего.
Не пейте ничего за 2 часа до запланированного времени прибытия. Сюда входит вода.
Что следует помнить
- Принимайте только те лекарства, которые ваш лечащий врач сказал вам принимать утром перед процедурой. Запивайте их несколькими глотками воды.
- Не наносите крем или вазелин (вазелин ® ). Можно использовать дезодорант и легкие увлажняющие крема.
- Не пользуйтесь косметикой для глаз.
- Снимите все украшения, включая пирсинг.

- Оставьте все ценные вещи, такие как кредитные карты и украшения, дома.
- Если вы носите контактные линзы, по возможности наденьте вместо них очки. Если у вас нет очков, возьмите с собой футляр для контактных линз.
Что взять с собой
- Список лекарств, которые вы принимаете дома
- Лекарства от проблем с дыханием (например, ингаляторы), лекарства от боли в груди или и то, и другое
- Футляр для очков или контактных линз
- Форма доверенности на медицинское обслуживание, если вы ее заполнили
- Если вы используете аппарат CPAP или BiPAP для ночного сна, по возможности возьмите с собой аппарат. Если вы не можете взять с собой свой аппарат, мы предоставим вам его для использования, пока вы находитесь в больнице.
Где припарковаться
Гараж MSK находится по адресу East 66 th Street между York и 1 st avenues. Если у вас есть вопросы о ценах, позвоните по телефону 212-639-2338.
Чтобы добраться до гаража, поверните на восточную 66 -ю -ю улицу от Йорк-авеню. Гараж находится примерно в четверти квартала от Йорк-авеню. Это на правой (северной) стороне улицы. Есть туннель, по которому можно пройти, который соединяет гараж с больницей.
Есть и другие гаражи, расположенные по адресу:
- Восток 69 -я -я улица между 1-й -й -й и 2-й -й -й проспект.
- East 67 th Street между York и 1 st avenues.
- Восток 65 -я -я улица между 1-й -й -й и 2-й -й -й проспект.
Куда идти
Пожалуйста, подойдите к главному зданию MSK по адресу 1275 York Avenue между улицами East 67 th и East 68 th . Поднимитесь на лифте М до 2 -й этаж. Войдите через стеклянные двери и зарегистрируйтесь на стойке регистрации.
Чего ожидать
Когда вы прибудете в больницу, врачи, медсестры и другие сотрудники много раз попросят вас назвать и произнести по буквам ваше имя и дату рождения. Это для вашей безопасности. Люди с одинаковыми или похожими именами могут проходить процедуры в один и тот же день.
Это для вашей безопасности. Люди с одинаковыми или похожими именами могут проходить процедуры в один и тот же день.
Ваш врач объяснит вам суть процедуры и ответит на любые ваши вопросы. Они попросят вас подписать форму согласия.
Когда придет время процедуры, медсестра/медбрат отведет вас в процедурный кабинет и поможет лечь на стол для осмотра. Член вашей бригады анестезиологов поместит внутривенный (в/в) катетер в вашу вену, обычно в вашу кисть или предплечье. Сначала вам будут вводить жидкости через капельницу, но позже она будет использоваться для анестезии (лекарства, вызывающего сонливость). Когда вы уснете, врач начнет процедуру.
НаверхВо время процедуры
Вы ляжете животом на стол с подушкой под бедрами. Ваша спина будет очищена, и вам сделают инъекцию, чтобы обезболить область примерно на середине спины. Ваш врач будет использовать рентгеновские лучи для направления иглы с блоком. Затем они введут лекарство в область чревного сплетения. Ваш врач удалит иглу и наложит повязку (лейкопластырь 9).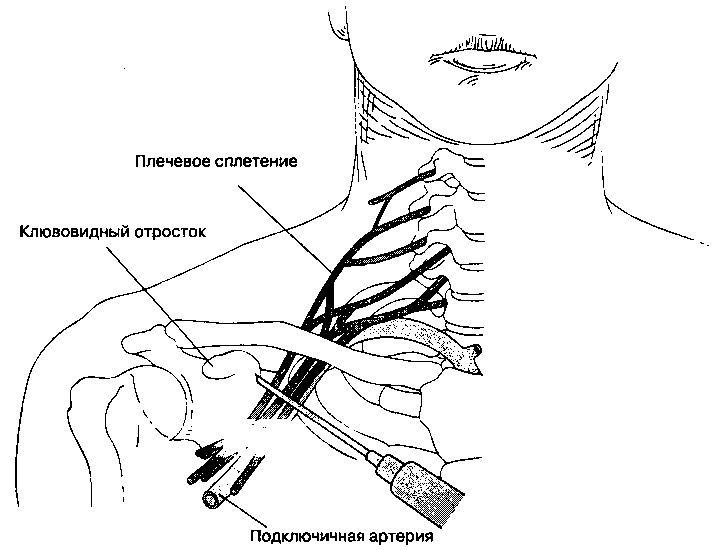 0066 ® ) на сайте.
0066 ® ) на сайте.
Ваша процедура займет около 90 минут.
НаверхПосле процедуры
В больнице
Когда вы проснетесь после процедуры, вы окажетесь в послеоперационном отделении анестезии (PACU). Медсестра будет контролировать температуру вашего тела, пульс, кровяное давление и уровень кислорода. Вы останетесь в PACU, пока полностью не проснетесь.
Когда вы проснетесь, вы можете:
- На мгновение почувствовать головокружение.
- Ощущение переполнения и тепла в животе.
- Тошнота, ощущение, что вас сейчас вырвет, или и то, и другое.
- Чувство сонливости или спутанности сознания. Вы останетесь в реанимационной палате, пока не почувствуете себя лучше.
Перед тем, как вы отправитесь домой, медсестра/медбрат вместе с вами и лицом, осуществляющим уход, просмотрит ваши инструкции по выписке.
Дома
- Вы можете продолжать принимать обезболивающие сразу после процедуры.
- В течение нескольких дней в области введения иглы может болеть спина.

- У вас может быть диарея (жидкий или водянистый стул) в течение 3–5 дней.
- Не садитесь за руль и не используйте тяжелую технику в течение 24 часов после процедуры.
- Не употребляйте алкоголь в течение 24 часов после процедуры.
- Вы можете снять пластырь ® вечером или на следующее утро после процедуры.
- Вы можете принять душ на следующий день после процедуры.
Один из ваших медицинских работников из Pain Service позвонит вам в течение 2–3 рабочих дней, чтобы узнать, как вы себя чувствуете.
Обезболивание
- Боль может усиливаться в течение 24 часов после процедуры. Возможно, вам придется принимать дополнительные дозы лекарства в течение 1–2 дней. Если боль продолжается более 48 часов (2 дней), позвоните своему врачу.
- Может пройти несколько дней или больше, прежде чем вы почувствуете полную силу блокады. Продолжайте принимать обезболивающие в соответствии с предписаниями. Ваш лечащий врач расскажет вам, как постепенно снижать дозу обезболивающего в зависимости от того, насколько хорошо блокада снимает боль.

Блокада чревного сплетения работает у всех по-разному. Блок может длиться от нескольких недель до нескольких месяцев. Когда это пройдет, ваш врач обсудит с вами другие варианты.
НаверхКогда звонить своему поставщику медицинских услуг
Позвоните своему поставщику медицинских услуг, если у вас есть что-либо из следующего:
- У вас температура 100,4° F (38° C) или выше.
- У вас есть изменения в вашей боли в течение 24-48 часов (1-2 дня) после процедуры.
- У вас покраснение или припухлость в месте инъекции.
- У вас возникли проблемы.
- У вас есть вопросы или опасения.
Контактная информация
Если у вас есть какие-либо вопросы или опасения, позвоните в Службу обезболивания по телефону 212-639-6851. Вы можете связаться с сотрудником с понедельника по пятницу с до После , в выходные или праздничные дни позвоните по номеру 212-639-2000 и попросите вызвать дежурного по обезболиванию.
Блокада чревного сплетения — StatPearls
Рина С. Джон; Брюс Диксон; Райан Шиенбаум.
Информация об авторе
Последнее обновление: 25 июля 2022 г.
Непрерывное обучение
Впервые описанный как метод обеспечения хирургической анестезии верхней части живота, блокада чревного сплетения (ЧСВ) использовалась на практике почти век. Блокада чревного сплетения нацелена на афферентные ноцицептивные волокна и может использоваться как в качестве диагностического метода, так и в качестве терапевтического инструмента для лечения интраабдоминальной боли. Основным показанием к блокаде чревного сплетения является боль в животе, не поддающаяся обезболиванию; часто эти пациенты не реагируют на лечение высокими дозами опиоидов. Состояния, при которых может быть полезна блокада чревного сплетения, включают непреодолимую внутрибрюшную боль, в том числе боль, связанную со злокачественными или доброкачественными новообразованиями, поражающими поджелудочную железу или другие забрюшинные органы, желчные протоки или другие органы брюшной полости. Одним из наиболее частых показаний к блокаде чревного сплетения является лечение болей в животе, связанных с раком поджелудочной железы. В этом упражнении описываются показания, противопоказания и техника выполнения блокады чревного сплетения, а также подчеркивается роль межпрофессиональной команды в лечении пациентов с непреодолимой болью в животе.
Одним из наиболее частых показаний к блокаде чревного сплетения является лечение болей в животе, связанных с раком поджелудочной железы. В этом упражнении описываются показания, противопоказания и техника выполнения блокады чревного сплетения, а также подчеркивается роль межпрофессиональной команды в лечении пациентов с непреодолимой болью в животе.
Цели:
Опишите анатомию чревного сплетения.
Опишите оборудование, необходимое для выполнения блокады чревного сплетения.
Ознакомьтесь с осложнениями, связанными с блокадой чревного сплетения.
Объясните подход структурированной межпрофессиональной команды к оказанию эффективной помощи пациентам, перенесшим блокаду чревного сплетения.
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Введение
Впервые описанная как метод обеспечения хирургической анестезии верхней части живота, блокада чревного сплетения (ЧЛС) применяется уже почти столетие. Блокада чревного сплетения используется в качестве дополнения к мультимодальному лечению абдоминальной висцеральной боли. Чревное сплетение состоит из трех пар ганглиев: чревных ганглиев, верхних брыжеечных ганглиев и аортокоренальных ганглиев. Несколько органов брюшной полости получают вегетативную иннервацию через чревное сплетение. Блокада чревного сплетения нацелена на афферентные ноцицептивные волокна и подходит для использования как в качестве диагностического, так и в качестве терапевтического инструмента для лечения внутрибрюшной боли.[1][2]
Блокада чревного сплетения используется в качестве дополнения к мультимодальному лечению абдоминальной висцеральной боли. Чревное сплетение состоит из трех пар ганглиев: чревных ганглиев, верхних брыжеечных ганглиев и аортокоренальных ганглиев. Несколько органов брюшной полости получают вегетативную иннервацию через чревное сплетение. Блокада чревного сплетения нацелена на афферентные ноцицептивные волокна и подходит для использования как в качестве диагностического, так и в качестве терапевтического инструмента для лечения внутрибрюшной боли.[1][2]
Анатомия и физиология
Из-за обширной паутины нервных волокон чревное сплетение также называют солнечным сплетением. Многие органы брюшной полости получают вегетативную иннервацию через чревное сплетение, включая печень, желчный пузырь, желудок, поджелудочную железу, селезенку, обе почки, всю тонкую кишку и первые две трети толстой кишки. Чревное сплетение состоит из чревного, аортального, почечного и верхнего брыжеечного ганглиев и расположено переднебоково от диафрагмы аорты на уровне L1 позвонков. Чревное сплетение состоит из парасимпатических и симпатических нервов. Симпатическая иннервация чревного сплетения берет начало от переднебокового рога спинного мозга на уровне от Т5 до Т12.[3][4]
Чревное сплетение состоит из парасимпатических и симпатических нервов. Симпатическая иннервация чревного сплетения берет начало от переднебокового рога спинного мозга на уровне от Т5 до Т12.[3][4]
Показания
Блокада чревного сплетения показана при непреодолимой боли в животе, которая не купируется менее агрессивными анальгетическими вмешательствами; часто этим пациентам требуется лечение высокими дозами опиоидов с небольшой клинической пользой. Эта блокада нацелена на висцеральные афферентные болевые волокна от печени, желчного пузыря, сальника, поджелудочной железы, брыжейки и пищеварительного тракта, начиная с желудка и заканчивая серединой поперечной ободочной кишки. Показаниями к блокаде чревного сплетения являются лечение некупируемых внутрибрюшных болей, в том числе болей на фоне злокачественных и доброкачественных новообразований поджелудочной железы, желчевыводящих путей, органов забрюшинного пространства и других органов брюшной полости. Одним из наиболее частых показаний к блокаде чревного сплетения является лечение болей в животе, связанных с раком поджелудочной железы. Использование блокады чревного сплетения для облегчения вторичной боли при хроническом панкреатите остается спорным. При выборе инъекций местные анестетики и стероиды предназначены для пациентов с доброкачественной патологией, в то время как нейролитическая блокада чревного сплетения обычно предназначена для лечения боли, связанной с раком.
Использование блокады чревного сплетения для облегчения вторичной боли при хроническом панкреатите остается спорным. При выборе инъекций местные анестетики и стероиды предназначены для пациентов с доброкачественной патологией, в то время как нейролитическая блокада чревного сплетения обычно предназначена для лечения боли, связанной с раком.
Основными показаниями для блокады чревного сплетения (CPB) являются боль в животе, которая не реагирует на менее агрессивные обезболивающие вмешательства, и часто эти пациенты не реагируют на терапию высокими дозами опиоидов. Эта блокада нацелена на печень, желчный пузырь, сальник, поджелудочную железу, брыжейку и пищеварительный тракт от желудка до поперечной толстой кишки. ИК показано при злокачественных опухолях, а также новообразованиях доброкачественного происхождения. Показания к CBP включают лечение висцеральной боли в животе и злокачественных новообразований поджелудочной железы, желчевыводящих путей, органов забрюшинного пространства и других органов брюшной полости.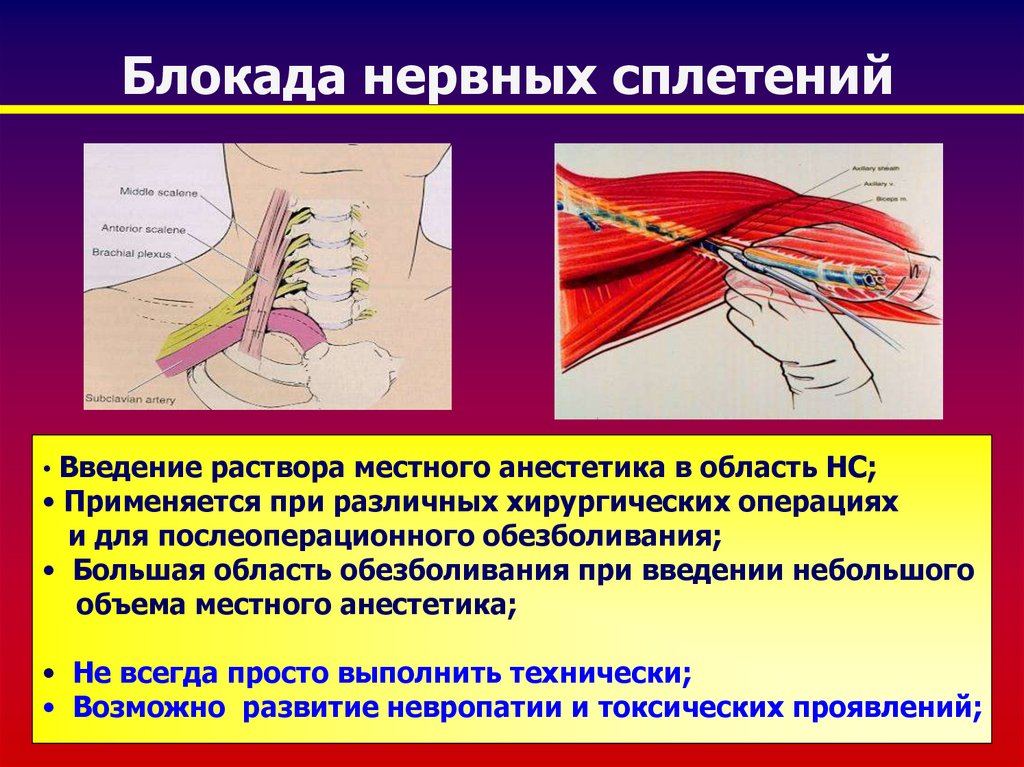 Одним из наиболее частых показаний к ИК является лечение боли, вызванной раком поджелудочной железы. Использование искусственного кровообращения при болях, вторичных по отношению к хроническому панкреатиту, до сих пор вызывает споры. Местные анестетики и стероиды предназначены для пациентов с доброкачественной патологией, тогда как нейролитический ИК обычно используется при болях, связанных с раком.[5][1]
Одним из наиболее частых показаний к ИК является лечение боли, вызванной раком поджелудочной железы. Использование искусственного кровообращения при болях, вторичных по отношению к хроническому панкреатиту, до сих пор вызывает споры. Местные анестетики и стероиды предназначены для пациентов с доброкачественной патологией, тогда как нейролитический ИК обычно используется при болях, связанных с раком.[5][1]
Противопоказания
Многие пациенты, которым может быть полезна эта процедура, имеют другие сопутствующие заболевания и основные процессы, которые необходимо учитывать перед выполнением этой блокады. Онкологические больные, проходящие химиотерапию или лучевую терапию, могут иметь ослабленный иммунитет, что делает их очень восприимчивыми к инфекциям, вторичным по отношению к инъекциям. Пациенты также могут иметь коагулопатию или тромбоцитопению, что создает повышенный риск значительного кровотечения. Даже при использовании КТ-контроля и рентгеноскопии необходимо помнить о метастатическом заболевании и других возможных образованиях, которые могут быть травмированными или сосудистыми.
Противопоказания к ИК аналогичны противопоказаниям для всех других блокад и включают отказ или неспособность пациента дать согласие, коагулопатию или применение антикоагулянтов, текущую инфекцию и аномалии анатомии, затрудняющие или затрудняющие наведение на соответствующую структуры.
Техника
Описано несколько подходов для выполнения блокады чревного сплетения (ЧЛС). Двумя наиболее часто применяемыми доступами являются задний парааортальный доступ и передний парааортальный доступ (более подробно они будут обсуждаться ниже). Передний парааортальный доступ следует рассматривать у пациентов с прогрессирующим заболеванием, у которых может быть дискомфорт в животе и которые не могут лежать в положении лежа, или у пациентов, перенесших абдоминальную операцию. Диагностический блок, состоящий из местного анестетика, должен быть выполнен перед нейролитическим блоком, чтобы подтвердить эффективность и облегчение боли, связанное с блоком. Как правило, в литературе алкоголь является предпочтительным средством для нейролитической блокады чревного сплетения, поскольку он считается более эффективным.
Задний парааортальный доступ
Больного следует уложить в положение лежа с опорой под живот для увеличения кифоза грудного отдела позвоночника. Перед выполнением блока отметьте следующие анатомические ориентиры: срединная линия позвоночника и тела позвонков, гребни подвздошных костей, 12-е ребро и латеральный край паравертебральных мышц. Кожа пациента должна быть тщательно продезинфицирована, а пораженный участок должен быть надлежащим образом покрыт драпировкой. С помощью рентгенологических инструментов определите тела позвонков T12 и L1. Нижний край 12-го ребра должен быть идентифицирован и отмечен стерильным способом. Кожный волдырь должен располагаться у нижнего края 12-го ребра примерно в 6–8 см от средней линии. Соответствующую иглу спинального типа следует продвигать под углом 45 градусов сзади вперед к вентральной поверхности межпозвонкового пространства T12-L1 до тех пор, пока не будет достигнут контакт с телом позвонка. После контакта с телом позвонка спинальную иглу следует ввести еще примерно на 1 см в превертебральную фасциальную плоскость. Как только игла находится в нужном положении, практикующий врач может подтвердить правильное локальное распространение контраста под контролем КТ или рентгеноскопии. В это время может быть проведена диагностическая блокада с местной анестезией или лечебная нейролитическая блокада. В случае односторонней блокады левосторонний доступ оказался надежным. Двусторонняя блокада может быть выполнена, если односторонняя блокада не дает достаточных результатов.
Как только игла находится в нужном положении, практикующий врач может подтвердить правильное локальное распространение контраста под контролем КТ или рентгеноскопии. В это время может быть проведена диагностическая блокада с местной анестезией или лечебная нейролитическая блокада. В случае односторонней блокады левосторонний доступ оказался надежным. Двусторонняя блокада может быть выполнена, если односторонняя блокада не дает достаточных результатов.
Передний парааортальный доступ
Этот подход особенно полезен у пациентов с прогрессирующим заболеванием, у которых может быть дискомфорт в животе и которые не могут лежать на животе, или у пациентов, перенесших абдоминальную операцию. Когда пациент находится в положении лежа на спине, траектория движения иглы отображается с помощью КТ или рентгеноскопического контроля. Впоследствии кожу следует продезинфицировать и подготовить так же, как при заднем парааортальном доступе. Местный анестезирующий кожный волдырь следует вводить в брюшную стенку непосредственно перед телом позвонка Т12.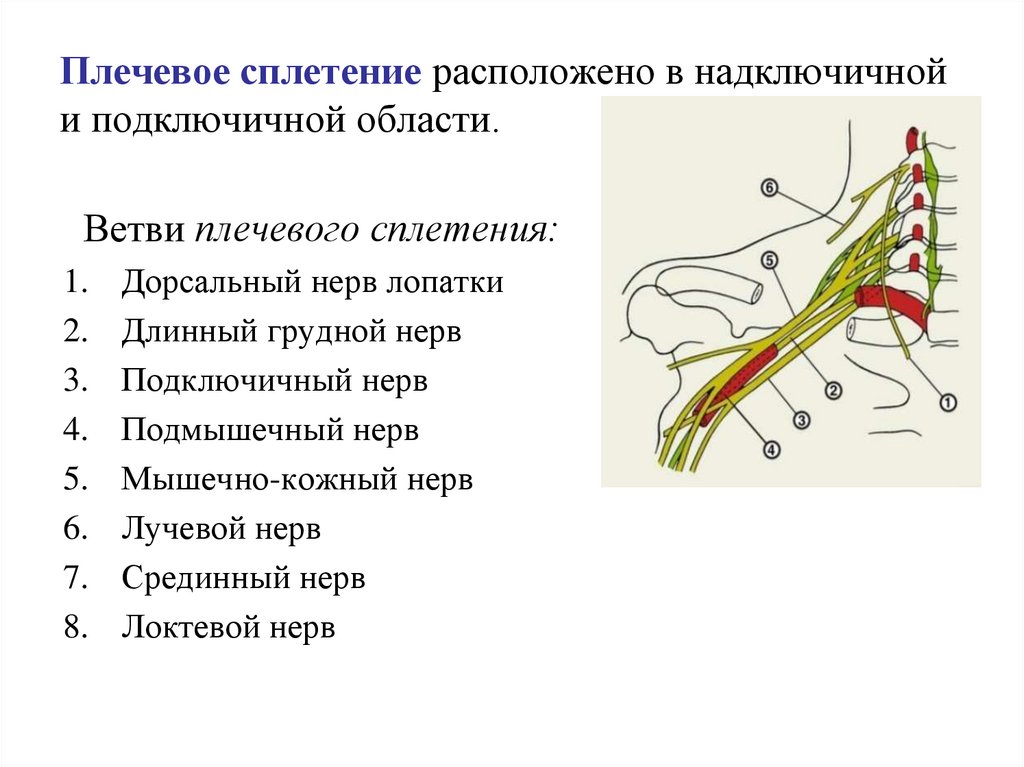 Соответствующая спинномозговая игла должна быть введена и направлена к брюшной аорте, ход иглы обычно проходит через внутренние органы брюшной полости, включая кишечник, желудок или печень. При окончательном положении кончика иглы кпереди от аорты и ножек диафрагмы нейролитик вводят в антекруральное пространство. Этот доступ часто быстрее, чем задний парааортальный доступ, и хорошо переносится пациентами; однако его использование ограничено возможностью повреждения органов.
Соответствующая спинномозговая игла должна быть введена и направлена к брюшной аорте, ход иглы обычно проходит через внутренние органы брюшной полости, включая кишечник, желудок или печень. При окончательном положении кончика иглы кпереди от аорты и ножек диафрагмы нейролитик вводят в антекруральное пространство. Этот доступ часто быстрее, чем задний парааортальный доступ, и хорошо переносится пациентами; однако его использование ограничено возможностью повреждения органов.
Осложнения
Хотя осложнения встречаются редко, необходимо знать о возможных осложнениях, которые могут возникнуть в результате блокады чревного сплетения. Осложнения, которые были отмечены при блокаде чревного сплетения (CPB), несмотря на использование КТ-контроля, включают ортостатическую гипотензию, внутрисосудистую инъекцию (осложнение, которое может возникнуть при любой блокаде), повреждение нервного корешка, парестезии, интратекальную или эпидуральную инъекцию. , повреждение/травма близлежащих органов, диарея, пневмоторакс, повреждение сосудов, инфекция/образование абсцесса, травма мышц, забрюшинная гематома, параплегия и токсичность местных анестетиков с поражением центральной нервной системы и сердечно-сосудистой системы. Всегда есть риск неудачного блока. Ортостатическую гипотензию, которая является наиболее частым осложнением, можно свести к минимуму при адекватной гидратации. Полная симпатическая денервация желудочно-кишечного тракта, вероятно, вызовет усиление перистальтики пациента из-за беспрепятственной активности парасимпатической нервной системы.
Всегда есть риск неудачного блока. Ортостатическую гипотензию, которая является наиболее частым осложнением, можно свести к минимуму при адекватной гидратации. Полная симпатическая денервация желудочно-кишечного тракта, вероятно, вызовет усиление перистальтики пациента из-за беспрепятственной активности парасимпатической нервной системы.
Клиническое значение
Рак поджелудочной железы является вторым наиболее распространенным видом рака брюшной полости в Соединенных Штатах. Боль, которую испытывают больные раком поджелудочной железы, описывается как сильная и часто не контролируемая лекарствами. Использование блокады чревного сплетения с нейролизом может уменьшить боль, испытываемую этими пациентами, снизить общее потребление опиоидов и повысить удовлетворенность пациентов.
Улучшение результатов работы команды здравоохранения
В условиях команды обязательно должна существовать замкнутая связь. Все пациенты должны иметь надлежащий тайм-аут. Имя пациента, дата рождения, любые относящиеся к делу аллергии и процедура, которую пациент проходил, должны быть согласованы между всеми поставщиками (анестезиологом, медсестрой, хирургом и др. ), а также с пациентом. Все согласия должны быть подписаны после подробного объяснения пациенту рисков, преимуществ и ожиданий. Крайне важно, чтобы проверка сайта и латеральность были подтверждены до начала любой процедуры. Доказано, что внедрение руководств и контрольных списков снижает вероятность неблагоприятных исходов, таких как недопонимание между хирургом и анестезиологом и процедуры регионарной анестезии с неправильным местом / неправильной стороной. (Уровень I)
), а также с пациентом. Все согласия должны быть подписаны после подробного объяснения пациенту рисков, преимуществ и ожиданий. Крайне важно, чтобы проверка сайта и латеральность были подтверждены до начала любой процедуры. Доказано, что внедрение руководств и контрольных списков снижает вероятность неблагоприятных исходов, таких как недопонимание между хирургом и анестезиологом и процедуры регионарной анестезии с неправильным местом / неправильной стороной. (Уровень I)
Важно, чтобы этот блок выполнялся с некоторой формой визуализации, чтобы можно было идентифицировать цель, а также окружающие структуры. В то время как большинство поставщиков проводят блокаду чревного сплетения под контролем КТ/рентгеноскопии, некоторые исследования показывают, что эндоскопический ультразвуковой контроль дает лучшие результаты, включая более длительный контроль боли, а также является более безопасным и эффективным вариантом с меньшими затратами. (Уровень II)
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.

Прокомментируйте эту статью.
Рисунок
Нейролитическая блокада чревного сплетения через задний доступ Боковой вид (1,2) и прямой вид (3). Предоставлено Риной Джон
Рисунок
блокада чревного сплетения. Изображение предоставлено S Bhimji MD
Ссылки
- 1.
Gunduz OH, Kenis-Coskun O. Блокада ганглиев как лечение боли: текущие перспективы. Джей Боль Рез. 2017;10:2815-2826. [Бесплатная статья PMC: PMC5734237] [PubMed: 29276402]
- 2.
Корнман-Хомонофф Дж., Хольцвангер Д.Дж., Ли К.С., Мэдофф Д.К., Ли Д. Блокада чревного сплетения и нейролиз в лечении хронической боли в верхней части живота. Семин Интервент Радиол. 2017 дек.; 34(4):376-386. [Бесплатная статья PMC: PMC5730442] [PubMed: 29249862]
- 3.
Ehrhardt JD, Weber C, Lopez-Ojeda W. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 8 августа 2022 г. Анатомия, грудная клетка, большие внутренние нервы.
 [В паблике: 29763202]
[В паблике: 29763202]- 4.
Росланд Дж.Х., Гейтунг Дж.Т. Нейролитическая блокада чревного сплетения под контролем КТ у пациентов с распространенным и трудноизлечимым раком поджелудочной железы. Сканд Джей Пейн. 2018 25 апреля; 18 (2): 247-251. [PubMed: 29794300]
- 5.
Ван Д. Технологии управления изображениями для интервенционных обезболивающих процедур: УЗИ, рентгеноскопия и КТ. Curr Pain Headache Rep. 26 января 2018 г .; 22 (1): 6. [PubMed: 29374352]
- 6.
Юсефшахи Ф., Тахмасеби М. Длительная ортостатическая гипотензия и запор после блокады чревного сплетения; Отчет о случае. Анест Болеутоляющее Мед. 2018 Февраль;8(1):e63221. [Статья PMC бесплатно: PMC5970361] [PubMed: 29868459]
- 7.
Slocombe P, Pattullo S. Проверка места перед регионарной анестезией для предотвращения неправильных блокад. Интенсивная терапия Анест. 2016 июль; 44 (4): 513-6. [PubMed: 27456184]
- 8.

 Время забора проб на анализ должно быть отмечено относительно времени развития реакции. Значения должны всегда сравниваться с базовыми, полученными позднее, после того как реакция будет купирована.
Время забора проб на анализ должно быть отмечено относительно времени развития реакции. Значения должны всегда сравниваться с базовыми, полученными позднее, после того как реакция будет купирована. Mechanisms of action of inhaled anesthetics. New England Journal Medicine 2003; 348:2110-24.
Mechanisms of action of inhaled anesthetics. New England Journal Medicine 2003; 348:2110-24. Avoidance of nitrous oxide for patients undergoing major surgery: arandomised controlled trial. Anesthesiology 2007; 107: 221-31.
Avoidance of nitrous oxide for patients undergoing major surgery: arandomised controlled trial. Anesthesiology 2007; 107: 221-31.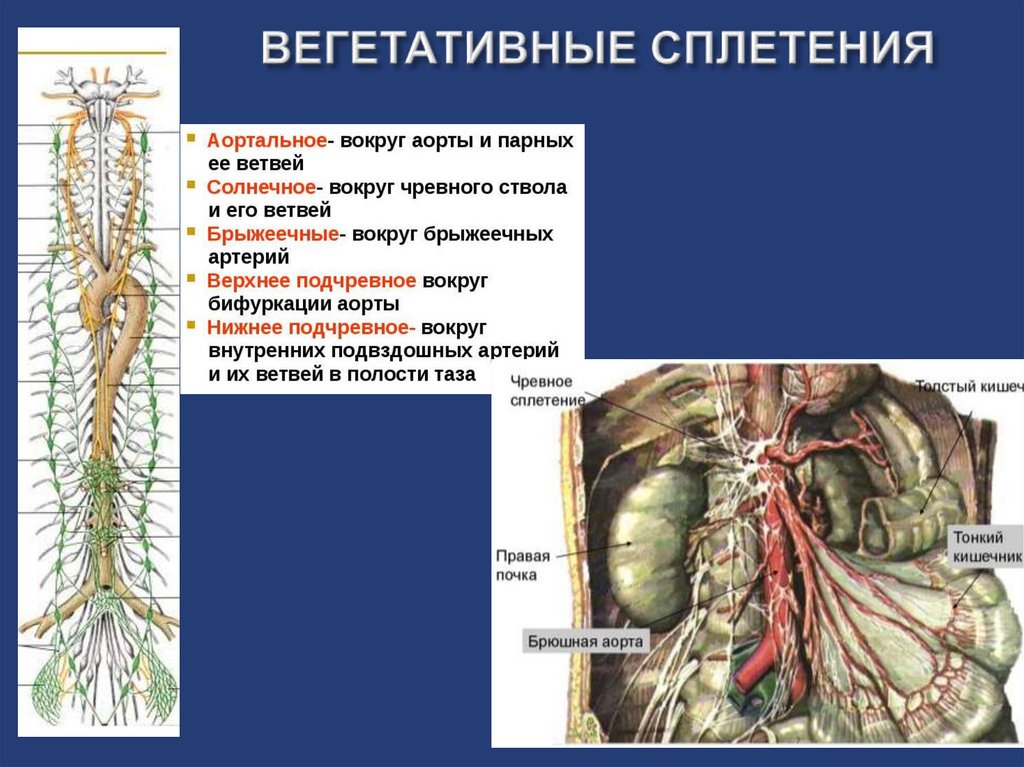 Methoxy-carbonyl etomidate: a novel rapidly metabolised ultra-short acting etomidate analogue that does not produce prolonged adrenocortical suppression. Anesthesiology 2009: 111: 240-9.
Methoxy-carbonyl etomidate: a novel rapidly metabolised ultra-short acting etomidate analogue that does not produce prolonged adrenocortical suppression. Anesthesiology 2009: 111: 240-9.
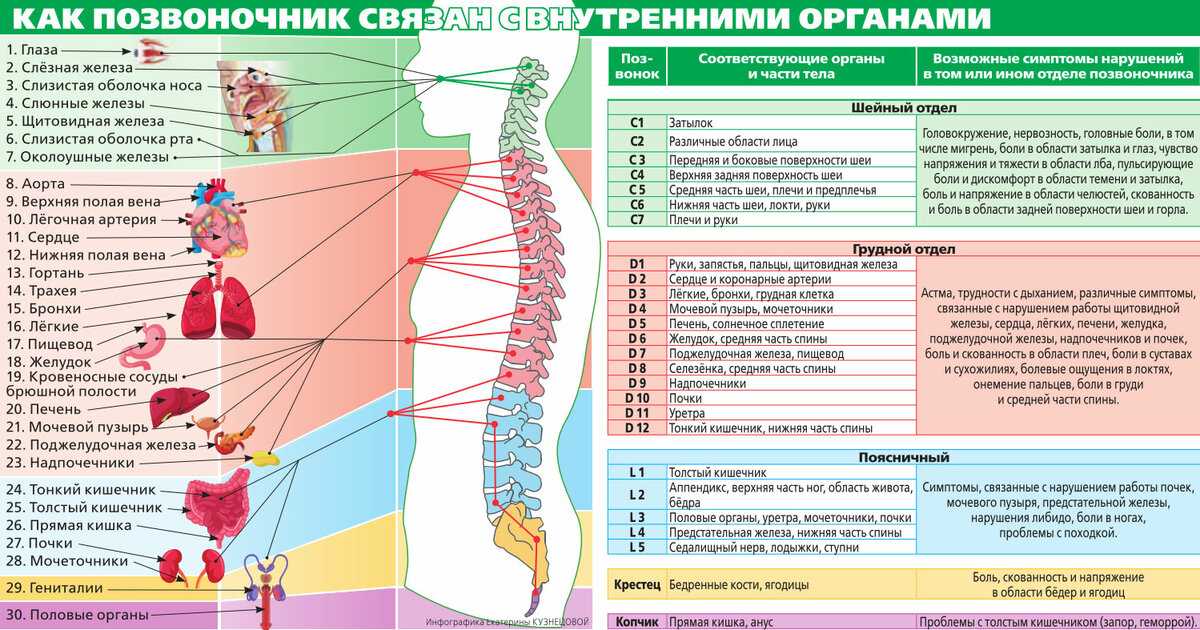

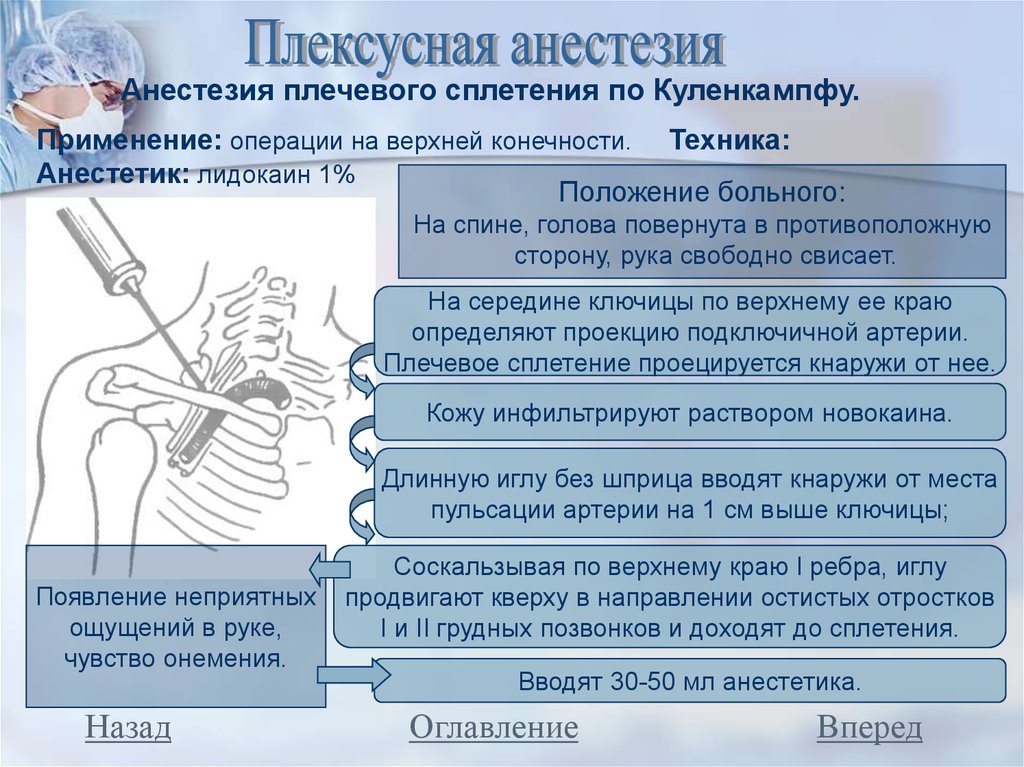
 [В паблике: 29763202]
[В паблике: 29763202]